
| A. | 10-3 | B. | 10-11 | C. | 10-14 | D. | 无法确定 |
分析 25℃时,向纯水中加入NaOH,使溶液的pH为11,该溶液中c(H+)=10-11 mol/L,由NaOH电离出的OH-离子浓度=$\frac{{K}_{w}}{c({H}^{+})}$.
解答 解:25℃时,向纯水中加入NaOH,使溶液的pH为11,该溶液中c(H+)=10-11 mol/L,由NaOH电离出的OH-离子浓度=$\frac{{K}_{w}}{c({H}^{+})}$=$\frac{1{0}^{-14}}{1{0}^{-11}}$mol/L=10-3mol/L,故选A.
点评 本题考查pH的有关计算,为高频考点,明确各个物理量的关系是解本题关键,注意碱中碱电离出c(OH-)与水电离出的c(OH-)关系,题目难度不大.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:选择题
| A. | 常温下,pH=11的NaOH和pH=11的KCN溶液中,水的电离程度相等 | |
| B. | 常温下,往Fe(OH)3悬浊液中分别加入少量NaClO、NH4Cl溶液,的溶解度都增大 | |
| C. | NH4Fe(SO4)2溶液中离子浓度关系:2c(SO42-)+c(OH-)=c(NH4+)+3c(Fe3+)+c(H+) | |
| D. | 10mL0.1mol•L-1CHCOONa溶液与6mL0.2mol•L-1盐酸混合后:c(Cl-)>c(Na+)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol | B. | 1.33mol | C. | 0.667mol | D. | 0mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应中KBrO3得电子作氧化剂 | |
| B. | 氧化剂和还原剂的物质的量比为5:8 | |
| C. | 根据上述反应可推知,还原性:AsH3>Br2 | |
| D. | 0.2 mol KBrO3参加反应电子转移1 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
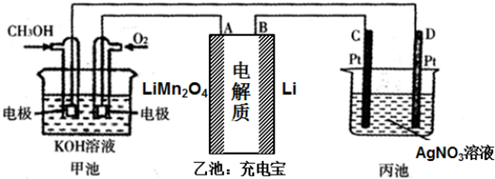
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
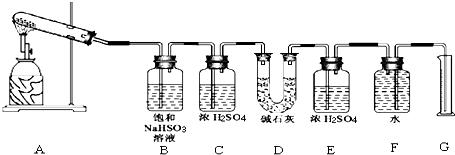
| 实验小组 | 称取CaSO4 的质量(g) | 装置D增加 的质量(g) | 量取气体体积的装置测量的气体体积 (折算成标准状况下气体的体积) (mL) |
| 一 | 4.08 | 2.56 | 224 |
| 二 | 5.44 | 2.56 | 448 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某浓差电池的原理示意如图所示,该电池从浓缩海水中提取LiCl的同时又获得了电能.下列有关该电池的说法正确的是( )
某浓差电池的原理示意如图所示,该电池从浓缩海水中提取LiCl的同时又获得了电能.下列有关该电池的说法正确的是( )| A. | 电子由X极通过外电路移向Y极 | |
| B. | 电池工作时,Li+通过离子导体移向b区 | |
| C. | 负极发生的反应为:2H++2e-═H2↑ | |
| D. | Y极每生成1 mol Cl2,a区得到2 mol LiCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2 | B. | NaCl | C. | BaSO4 | D. | 葡萄糖 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com