
 .
.
 .
. .
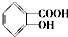
. 分析 芳香酯类化合物A、B互为同分异构体,均只含C、H、O三种元素,A、B蒸气对氢气的相对密度是97,则二者相对分子质量为97×2=194,分子中所含氧元素的质量分数均约为0.33,则分子中O原子数为$\frac{194×0.33}{16}$=4,分子中C、H原子总相对原子质量质量为194-64=130,则$\frac{130}{12}$=10…10,故含有C、H原子数目均为10,则A、B分子式为C10H10O4.A、B水解均得到水杨酸,可知C、D碳原子总数与E、F碳原子总数相等,即均为3,F经连续氧化可生成C,说明F为醇,C为酸,C和D是相对分子质量相同的不同类有机物,则D应为CH3CH2OH,C为HCOOH,故F为CH3OH,E为CH3COOH,由此可知A为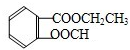 ,B为
,B为 ,据此解答.
,据此解答.
解答 解:芳香酯类化合物A、B互为同分异构体,均只含C、H、O三种元素,A、B蒸气对氢气的相对密度是97,则二者相对分子质量为97×2=194,分子中所含氧元素的质量分数均约为0.33,则分子中O原子数为$\frac{194×0.33}{16}$=4,分子中C、H原子总相对原子质量质量为194-64=130,则$\frac{130}{12}$=10…10,故含有C、H原子数目均为10,则A、B分子式为C10H10O4.A、B水解均得到水杨酸,可知C、D碳原子总数与E、F碳原子总数相等,即均为3,F经连续氧化可生成C,说明F为醇,C为酸,C和D是相对分子质量相同的不同类有机物,则D应为CH3CH2OH,C为HCOOH,故F为CH3OH,E为CH3COOH,由此可知A为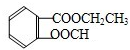 ,B为
,B为 .
.
(1)由上述分析可知,A的分子式为C10H10O4,故答案为:C10H10O4;
(2)由上述分析可知,B的结构简式是 ,故答案为:
,故答案为: ;
;
(3)D为CH3CH2OH,改写为C2H4.H2O,而C3H6O3改写为C2H4.CO2.H2O,C3H8O改写为C3H6.H2O,C2H6O2改写为C2H2.2H2O,C3H8O、C2H6O2消耗氧气与乙醇不同,C3H6O3、C2H4 与乙醇消耗氧气相等,
故选:ac;
(4)C与F反应的化学方程式是:HCOOH+CH3OH$→_{△}^{浓硫酸}$HCOOCH3+H2O,
故答案为:HCOOH+CH3OH$→_{△}^{浓硫酸}$HCOOCH3+H2O;
(5)同时符合下列条件的同分异构体:①与A互为同分异构体;②可以水解,含有酯基;③苯环上有两个取代基,且苯环上的一氯代物只有一种,说明两个取代基相同且处于对位,符合条件的同分异构体为: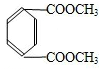 、
、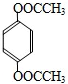 、
、 ,故答案为:3;
,故答案为:3;
(4)1mol上述(5)的同分异构体中有一种有机物X,能与含4mol NaOH溶液恰好完全反应,X为 ,此反应的化学方程式为:
,此反应的化学方程式为: ,
,
故答案为: .
.
点评 本题考查有机物的推断,关键是计算确定A、B分子式,注意根据F连续氧化生成C判断物质含有的官能团,结合分子式判断C、D含有含有碳原子数目,再结合二者相对分子质量推断,题目难度中等.


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:选择题
| A. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ | B. | 2FeO+Si$\frac{\underline{\;高温\;}}{\;}$2Fe+SiO2 | ||
| C. | SiO2+3C$\frac{\underline{\;高温\;}}{\;}$SiC+2CO↑ | D. | CaO+SiO2$\frac{\underline{\;高温\;}}{\;}$CaSiO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①③ | C. | ②④ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | Na+ | H+ | Ba2+ |
| 阴离子 | OH- | CO32- | SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
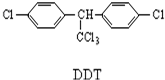
| A. | 它属于芳香烃 | B. | 分子式为C14H8Cl5 | ||
| C. | 1mol该物质能与6mol H2加成 | D. | 分子中最多可能有28个原子共面 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. |  | C. |  | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | HNO3 | B. | H3 PO4 | C. | H2CO3 | D. | H2 SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
C2H5Cl | C2H5Br | C2H5I | |
密度(g•cm-3) | 0.897 | 1.14 | 1.25 |
沸点(℃) | 12.3 | 38.4 | 42.5 |
| A. | ①③ | B. | ①② | C. | ②③ | D. | ②④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com