
【题目】已知:[FeCl4(H2O)2]-呈黄色,由下列实验所得结论不正确的是( )
① | ② | ③ | ④ |
0.1mol/L Fe2(SO4)3溶液 |
酸化的0.1mol/L Fe2(SO4)3溶液 |
酸化的0.1mol/L Fe2(SO4)3溶液 |
0.1mol/L FeCl3溶液 |
加热前溶液为浅黄色,加热后颜色变深 | 加热前溶液接近无色,加热后溶液颜色无明显变化 | 加入NaCl后,溶液立即变为黄色,加热后溶液颜色加深 | 加热前溶液为黄色,加热后溶液颜色变深 |
注:加热为微热,忽略溶液体积变化。
A.实验①中,Fe2(SO4)3溶液显浅黄色的原因是Fe3+水解产生了少量Fe(OH)3
B.实验②中,酸化对Fe3+水解的影响程度大于温度的影响
C.实验③中,存在平衡:Fe3+ +4Cl- +2H2O![]() [FeCl4(H2O)2]-
[FeCl4(H2O)2]-
D.实验④中,可证明升高温度,Fe3+水解平衡一定正向发生移动
【答案】D
【解析】
A. 加热促进水解,Fe3+ +3H2O![]() Fe(OH)3+3H+,实验①中,Fe2(SO4)3溶液显浅黄色的原因是Fe3+水解产生了少量Fe(OH)3,A正确;
Fe(OH)3+3H+,实验①中,Fe2(SO4)3溶液显浅黄色的原因是Fe3+水解产生了少量Fe(OH)3,A正确;
B. 由Fe3+ +3H2O![]() Fe(OH)3+3H+可知,酸化后加热溶液颜色无明显变化,H+抑制水解,实验②中,酸化对Fe3+水解的影响程度大于温度的影响,B正确;
Fe(OH)3+3H+可知,酸化后加热溶液颜色无明显变化,H+抑制水解,实验②中,酸化对Fe3+水解的影响程度大于温度的影响,B正确;
C. 加入NaCl后,溶液立即变为黄色,发生Fe3+ +4Cl- +2H2O![]() [FeCl4(H2O)2]-,[FeCl4(H2O)2]-呈黄色,加热时平衡正向移动,溶液颜色加深,C正确;
[FeCl4(H2O)2]-,[FeCl4(H2O)2]-呈黄色,加热时平衡正向移动,溶液颜色加深,C正确;
D. 实验④中,存在Fe3+ +4Cl- +2H2O![]() [FeCl4(H2O)2]-,升高温度平衡正向移动,溶液颜色加深,不能证明升高温度,Fe3+水解平衡一定正向发生移动,D错误;
[FeCl4(H2O)2]-,升高温度平衡正向移动,溶液颜色加深,不能证明升高温度,Fe3+水解平衡一定正向发生移动,D错误;
答案为D。


科目:高中化学 来源: 题型:
【题目】钴的化合物在工业生产、生命科技等行业有重要应用。
(1)Co2+的核外电子排布式为___,Co的第四电离能比Fe的第四电离能要小得多,原因是___。
(2)Fe、Co均能与CO形成配合物,如Fe(CO)5、Co2(CO)8的结构如图1、图2所示,图1中1molFe(CO)5含有__mol配位键,图2中C原子的杂化方式为___,形成上述两种化合物的四种元素中电负性最大的是___(填元素符号)。
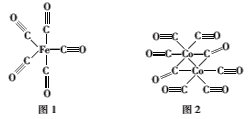
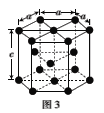
(3)金属钴的堆积方式为六方最密堆积,其配位数是___,钴晶体晶胞结构如图3所示,该晶胞中原子个数为___;该晶胞的边长为anm,高为cnm,该晶胞的密度为___(NA表示阿伏加德罗常数的值,列出代数式)g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原电池装置如图所示,电池总反应为2Ag+Cl2=2AgCl。下列说法正确的是
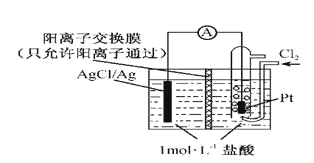
A. 正极反应为AgCl +e-=Ag +Cl-
B. 放电时,交换膜右侧溶液中有大量白色沉淀生成
C. 若用NaCl溶液代替盐酸,则电池总反应随之改变
D. 当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如右图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中。下列分析正确的()

A. K1闭合,铁棒上发生的反应为2H++2e-=H2↑
B. K1闭合,石墨棒周围溶液碱性增强
C. K2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法
D. K2闭合,电路中通过0.002NA个电子时,两极共产生0.001mol气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中科院长春应化所张新波团队提出了一种独特的锂-氮电池(Li-N2),该电池在放电过程中消耗氮气,充电过程中释放氮气,实现氮气的循环,并对外提供电能。该电池在充电时发生反应:2Li3N![]() N2↑+6Li。现以该电池为电源进行如图所示实验,下列说法正确的是( )
N2↑+6Li。现以该电池为电源进行如图所示实验,下列说法正确的是( )
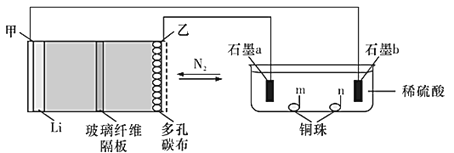
A.乙电极上的反应为2Li3N-6e-=N2↑+6Li+
B.充电过程中Li+由甲电极迁移向乙电极,并在多孔碳布表面生成Li3N
C.电极“石墨a”和m、n处均可能有铜析出
D.锂氮电池为绿色固氮提供了一种可能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在2L容器中3种物质间进行反应,X,Y,Z的物质的量随时间的变化曲线如图,反应在t1 min时到达平衡,如图所示:

(1)该反应的化学方程式是_________。若t1=10min,用X表示化学反应速率为_________
(2)若上述反应中X,Y,Z分别为NH3、H2、N2, 且已知1mol氨气分解成氮气和氢气要吸收46kJ的热量,则至t1 min时,该反应吸收的热量为_______;
(3)保持容器温度不变,缩小容器体积,化学反应速率_______(填“增大”或“减小”或“不变”)。化学平衡常数K_______ (填“增大”或“减小”或“不变”)
(4)在一定容积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
t/℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
①该反应的化学平衡常数表达式为K=__________
②能判断该反应达到化学平衡状态的依据是_______
A.容器中压强不变 B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O) D.c(CO2)=c(CO)
(5)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为__________℃;
(6)在800℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)=2mol·L-1,c(H2)=1.5mol·L-1,c(CO)=1mol·L-1,c(H2O)=3mol·L-1,则下一时刻,反应向__________(填"正反应"或"逆反应")方向进行。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】交警用三氧化铬(CrO3)硅胶可以查酒驾。元素Cr的几种化合物转化关系如图所示。下列判断正确的是
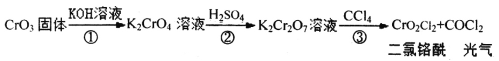
A.反应①表明CrO3有酸性氧化物的性质
B.CrO42-在碱性溶液中不能大量存在
C.只有反应③为氧化还原反应
D.基态铬原子的价电子排布式为3d44s2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积相同的两个密闭容器M和N中,保持温度为150 ℃,向M容器中加入a mol HI,同时向N容器中加入b mol HI (a>b)。当反应2HI(g)![]() H2 (g) + I2 (g) 达到平衡后,下列说法正确的是
H2 (g) + I2 (g) 达到平衡后,下列说法正确的是
A.从反应开始到达到平衡,所需时间tM > tN
B.平衡时cM(I2) = c N(I2)
C.平衡时I2 蒸气在混合气体中的体积分数:M > N
D.HI的平衡分解率αM = αN
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将NaOH溶液滴加到HA溶液中,测得混合溶液的pH与p![]() 转化关系如图所示[已知:p
转化关系如图所示[已知:p![]() =-lg
=-lg![]() ]。下列叙述错误的是( )
]。下列叙述错误的是( )

A.m点:c(A-)=c(HA)
B.Ka(HA)的数量级为10-6
C.水的电离程度:m<r
D.r点:c(H+)+c(Na+)=c(A-)+c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com