
 .
. .
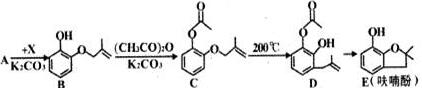
.分析 (1)对比B、C的结构可知,B中酚-OH上的H被取代;由E的结构可知书写其分子式;D中酚羟基与氢氧化钠反应,且酯基水解得到羧基、酚羟基与氢氧化钠反应;
(2)对比A、B的结构,可知A→B属于取代反应,则X为CH2=CH(CH3)CH2Cl,反应还有HCl生成;
(3)Y是X的同分异构体,分子中无支链且不含甲基,则Y为CH2=CHCH2CH2Cl;
(4)C、D分子式相同,结构不同,互为同分异构体,C、D均含有碳碳双键,能与溴发生加成反应,而C含有醚键、D含有酚羟基,二者含有官能团不同,酚羟基邻位、对位能与溴发生取代反应;
(5)B的芳香族同分异构体满足:①苯环上有两个取代基,②能发生银镜反应,说明含有醛基,③能发生水解反应,含有甲酸形成的酯基,2个取代基为-CH3、-CH2CH2OOCH,或者为-CH3、-CH(CH3)OOCH,
或者为-CH2CH3、-CH2OOCH,或者为-CH2CH2CH3、-OOCH,或者为-CH(CH3)2、-OOCH,各有邻、间、对3种;
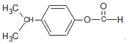
(6)(CH3)3CH光照生成(CH3)2CHCH2Cl,在氢氧化钠醇溶液、加热条件下发生消去反应生成(CH3)2C=CH2,与HClO发生加成反应生成 ,最后在浓硫酸、加热条件下发生消去反应生成CH2=CH(CH3)CH2Cl.
,最后在浓硫酸、加热条件下发生消去反应生成CH2=CH(CH3)CH2Cl.
解答 解:(1)对比B、C的结构可知,B中酚-OH上的H被取代,B→C的反应属于取代反应;由E的结构可知,其分子式为C10H12O2;D中酚羟基与氢氧化钠反应,且酯基水解得到羧基、酚羟基与氢氧化钠反应,1molD最多可以消耗3molNaOH,
故答案为:取代反应;C10H12O2;3;
(2)对比A、B的结构,可知A→B属于取代反应,则X为CH2=CH(CH3)CH2Cl,反应还有HCl生成,反应方程式为: ,
,
故答案为: ;
;
(3)Y是X的同分异构体,分子中无支链且不含甲基,则Y为CH2=CHCH2CH2Cl,系统命名为:4-氯-1-丁烯,故答案为:4-氯-1-丁烯;
(4)①C含有醚键、D含有酚羟基,二者含有官能团不完全同,故①错误;
②C、D分子式相同,结构不同,互为同分异构体,故②正确;
③碳碳双键均与溴发生加成反应,C含有醚键、D含有酚羟基,D中酚羟基对位可以与溴发生取代反应,消耗Br2的物质的量不相同,故③错误;
故答案为:①③;
(5)B的芳香族同分异构体满足:①苯环上有两个取代基,②能发生银镜反应,说明含有醛基,③能发生水解反应,含有甲酸形成的酯基,2个取代基为-CH3、-CH2CH2OOCH,或者为-CH3、-CH(CH3)OOCH,
或者为-CH2CH3、-CH2OOCH,或者为-CH2CH2CH3、-OOCH,或者为-CH(CH3)2、-OOCH,各有邻、间、对3种,共有15种,其中核磁共振氢谱峰面积比为1:1:2:2:6的结构简式为: ,
,
故答案为:15; ;
;
(6)(CH3)3CH光照生成(CH3)2CHCH2Cl,在氢氧化钠醇溶液、加热条件下发生消去反应生成(CH3)2C=CH2,与HClO发生加成反应生成 ,最后在浓硫酸、加热条件下发生消去反应生成CH2=CH(CH3)CH2Cl,合成路线流程图为:
,最后在浓硫酸、加热条件下发生消去反应生成CH2=CH(CH3)CH2Cl,合成路线流程图为: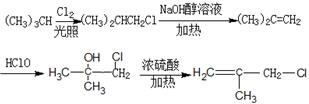 ,
,
故答案为: .
.
点评 本题考查有机物的合成、有机物结构与性质、同分异构体书写等,注意根据合成流程中的反应、官能团变化等分析解答,侧重分析与应用能力的考查,难度中等.


 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:选择题

| A. | 可以选用方案Ⅰ分离NaCl中的I2 | |
| B. | 方案Ⅰ中X物质不可能是受热易分解的物质 | |
| C. | 方案Ⅱ中加入NaOH溶液可以分离出含SiO2的Fe2O3 | |
| D. | 方案Ⅱ中加入的也可以是能够溶解除X外的其余物质的试剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
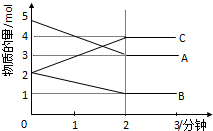 某可逆反应在体积为2升的密闭容器中进行反应(A、B、C均为气体),在不同反应时间各物质的量的变化情况如图所示.则:
某可逆反应在体积为2升的密闭容器中进行反应(A、B、C均为气体),在不同反应时间各物质的量的变化情况如图所示.则:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④⑤⑦ | B. | ④⑤⑦ | C. | ④⑤ | D. | ①④⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol ${\;}_{92}^{235}$U核素含有中子数为235NA | |
| B. | 1 L 0.l mol•L-1的醋酸溶液中含有H+数目为0.1NA | |
| C. | 标准状况下,22.4L乙烯和丙烯的混合气体中含有的碳原子数目为2.5NA | |
| D. | 常温常压下,l.6gCH4中含有共价键总数为0.4 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 环境问题已经是我国面临的重大问题.
环境问题已经是我国面临的重大问题.| 化学键 | C=0 | H-H | C-C | C-H | 0-H | C-0 |
| 键能/kJ.mol-1 | 803 | 436 | 332 | 409 | 463 | 326 |
| 成分 | 含量/(mg/L) | 成分 | 含量(mg/L) |
| Cl- | 18980 | Ca2+ | 400 |
| Na+ | 10560 | HCO3-; | 142 |
| SO42- | 2560 | Mg2+ | 1272 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com