
现将氯化铝溶液蒸干灼烧并熔融后用铂电极进行电解,下列有关电极产物的判断正确的是 ( )
A.阴极产物是氢气 B.阳极 产物是氧气
产物是氧气
C.阴极产物是铝和氧气 D.阳极产物只有氯气
D.阳极产物只有氯气
科目:高中化学 来源: 题型:
现有①MgSO4 ②Ba(NO3)2 ③NaOH ④CuCl2四种溶液,不加其他试剂即可鉴别出来,鉴别的先后顺序是( )
A.③④②① B.③④①②
C.②①③④ D.④③①②
查看答案和解析>>
科目:高中化学 来源: 题型:
以下食品化学知识的叙述不正确的是( )
A.食盐可作调味剂,也可作食品防腐剂
B.新鲜蔬菜做熟后,所含维生素C会有损失
C.纤维素在人体内可水解为葡萄糖,故可做人类的营养物质
D.葡萄糖中的花青素在碱性环境下显蓝色,故可用苏打粉检验假红酒。
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室用下列两种方法制氯气:①用含HCl 146 g的浓盐酸与足量的MnO2反应;②用87 g
MnO2与足量浓盐酸反应。所得的氯气 ( )
A.①比②多 B.②比①多
C.一样多 D.无法比较
查看答案和解析>>
科目:高中化学 来源: 题型:
下列举措不能防止或减缓钢铁腐蚀的是 ( )
A.在钢铁制品表面镀一层金属锌
B.将钢铁制品放置在潮湿处
C.在钢铁中加入锰、铬等金属,以改变钢铁结构
D.将钢铁制品与电源负极相连
查看答案和解析>>
科目:高中化学 来源: 题型:
在钢铁腐蚀过程中,下列五种变化可能发生的是 ( )
①Fe2+转化为Fe3+ ②O2被还原 ③产生H2
④Fe(OH)3失水形成Fe2O3·H2O ⑤杂质碳被氧化
A.只有①和② B.只有②③④
C.①②③④ D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
利用图6所示装置(电极均为惰性电极)可吸收SO2,并用阴极排出的溶液吸收NO2。下列说法正确的是
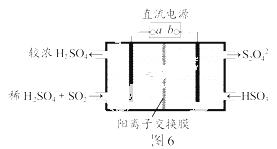 A.a为直流电源的负极
A.a为直流电源的负极
B.阴极的电极反应式为:
2HSO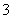 +2H++e-===S2O
+2H++e-===S2O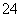 +2H2O
+2H2O
C.阳极的电极反应式为:
SO2+2H2O-2e-===SO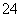 +4H+
+4H+
D.电解时,H+由阴极室通过阳离子交换膜到阳极室
查看答案和解析>>
科目:高中化学 来源: 题型:
右图装置中发生反应的离子方程式为Zn+2H+—→Zn2++H2↑,下列说法错误的是( )
A.a、b不可能是同种材料的电极
B.该装置可能是电解池,电解质溶液为稀盐酸
C.该装置可能是原电池,电解质溶液为稀盐酸
D.该装置可看作是铜-锌原电池,电解质溶液是稀硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
以铬铁矿(主要成分为FeO和Cr2O3 ,含有Al2O3、SiO2等杂质)为主要原料生产化工原料红矾钠(红矾钠的主要成分为重铬酸钠:Na2Cr2O7·2H2O) ,其主要工艺流程如下:
,其主要工艺流程如下:
|
|
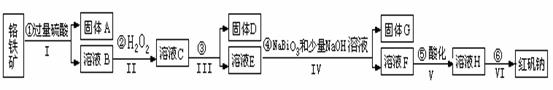
查阅资料得知:
i. 常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下,能将Cr3+转化为CrO42-。
|
回答下列问题:
(1)反应之前先将矿石粉碎的目的是 。
(2)操作I、III、IV用到的主要玻璃仪器有玻璃棒和__________(填仪器名称)。
(3)写出④反应的离子反应方程式 。
(4)⑤中酸化是使CrO42-转化为Cr2O72-,写出该反应的离子方程式 。
(5)将溶液H经过下列操作,蒸发浓缩,__________,过滤,洗涤,干燥即得红矾钠。
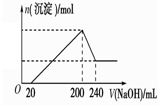
(6)取一定质量的固体D溶解于200mL的硫酸中,向所得溶液中加入5mol/L的NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V关系如右图所示,则硫酸的浓度为 ,固体D中含Fe化合物的物质的量为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com