
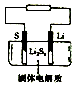
 石墨烯锂硫电池是一种高效、低污染的新型二次电源,其装置如图所示.电池反应为 2Li+nS=Li2Sn.Li+可在固体电解质中迁移.下列说法不正确的是( )
石墨烯锂硫电池是一种高效、低污染的新型二次电源,其装置如图所示.电池反应为 2Li+nS=Li2Sn.Li+可在固体电解质中迁移.下列说法不正确的是( )| A. | 放电时,锂在负极上发生氧化反应 | |
| B. | 放电时,正极的电极反应式为nS+2e-+2Li+=Li2Sn | |
| C. | 充电时,锂电极为阴极,与电源负极相连 | |
| D. | 充电时,理论上阳极失去2mol电子生成32g硫 |
分析 由电池反应为 2Li+nS=Li2Sn,则放电时,锂在负极上发生氧化反应,电极反应式为Li-e-=Li+,S电极为正极,发生还原反应,电极反应式为nS+2e-+2Li+=Li2Sn,充电时,阴阳极反应与负极、正极反应刚好相反,根据电极反应式结合电子转移进行计算即可.
解答 解:A、由电池反应为 2Li+nS=Li2Sn,则放电时,锂在负极上发生氧化反应,故A正确;
B、放电时,S电极为正极,发生还原反应,电极反应式为nS+2e-+2Li+=Li2Sn,故B正确;
C、充电时,阴极反应与负极反应刚好相反,所以锂电极为阴极,与电源负极相连,故C正确;
D、充电时,阳极反应与正极反应刚好相反,即Li2Sn-2e-=nS+2Li+,所以理论上阳极失去2mol电子生成32ng硫,故D错误.
故选D.
点评 本题考查了原电池和电解池原理,明确各个电极上发生的电极反应是解本题关键,难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 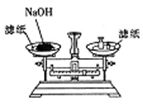 称取一定的NaOH | |
| B. | 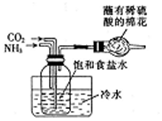 制取Na2CO3 | |
| C. | 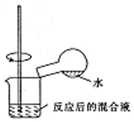 检验浓硫酸与铜反应后的产物中是否含有铜离子 | |
| D. |  收集NO2并防止其污染环境 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 粗铜作阳极 | |
| B. | 用CuSO4溶液作电解液 | |
| C. | 阴极的电极反应式:Cu2++2e-=Cu | |
| D. | 当阳极质量减少ag时,阴极质量增加ag |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,向含Ag2S固体的溶液中滴加少量Na2S溶液,c(Ag+)、c(S2-)、Ksp(Ag2S)都减小 | |
| B. | 常温下,pH=10的K2CO3溶液和pH=4的FeCl3溶液中,水的电离程度后者小 | |
| C. | 含KHSO3和K2SO3的中性混合溶液中有c(K+)=c(HSO3-)+2c(SO32-) | |
| D. | 常温下,将pH=2的HX溶液稀释1000倍,稀释后溶液的pH一定为5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 现象 | 结论 |
| A | 向KI溶液中加入CCl4,振荡后静置 | 液体分层,下层呈紫红色 | 碘易溶于CCl4,难溶于水 |
| B | 用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热 | 熔化后的液态铝滴落下来 | 金属铝的熔点较低 |
| C | 向含有酚酞的Na2CO3溶液中加入少量的BaCl2固体 | 溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
| D | 向亚硫酸钠试样中滴入盐酸酸化的Ba(ClO)2溶液 | 产生白色沉淀 | 试样已氧化变质 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 短周期主族元素,a、b、c、d的原子序数依次增大.四种元素形成的单质依次为m、n、p、q,其 中q为淡黄色固体;x、y、z是这些元素组成的二元化合物;25℃,0.01mol•L-1w溶液中$\frac{c({H}^{+})}{c(O{H}^{-})}$=1.0×10-10.上述物质的转化关系如图所示.下列说法正确的是 ( )
短周期主族元素,a、b、c、d的原子序数依次增大.四种元素形成的单质依次为m、n、p、q,其 中q为淡黄色固体;x、y、z是这些元素组成的二元化合物;25℃,0.01mol•L-1w溶液中$\frac{c({H}^{+})}{c(O{H}^{-})}$=1.0×10-10.上述物质的转化关系如图所示.下列说法正确的是 ( )| A. | 离子半径的大小:a<b<c<d | |
| B. | b氢化物的沸点高于主族其它元素氢化物的沸点 | |
| C. | 将b、c、d组成的化合物加入到水中对水的电离没有影响 | |
| D. | y、w含有的化学键类型完全相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应达到平衡时,放出热量为QkJ | |
| B. | 若容器的压强不再发生交化,则反应达到平衡 | |
| C. | 反应过程中c(SO2)+c(SO3)=1 mol•L-1恒成立 | |
| D. | 平衡时,SO2、O2的转化率相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤经过气化、液化等物理变化可转变为清洁燃料 | |
| B. | 在食品包装时放入盛有铁粉的透气小袋可防止食品氧化变质 | |
| C. | 为补充土壤中的钾元素,可在田间焚烧桔秆 | |
| D. | 聚乙烯、聚氯乙烯均可作包装材料,且不会造成环境污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 X、Y、Z 三种短周期元素,原子半径的大小关系为:r(Y)>r(X)>r(Z),原子序 数之和为 16.X、Y、Z 三种元素的常见单质在适当条件下可发生如图所示变化,其中 B 和 C 均为 10 电子分子.下列说法不正确的是( )
X、Y、Z 三种短周期元素,原子半径的大小关系为:r(Y)>r(X)>r(Z),原子序 数之和为 16.X、Y、Z 三种元素的常见单质在适当条件下可发生如图所示变化,其中 B 和 C 均为 10 电子分子.下列说法不正确的是( )| A. | X 元素位于ⅥA | B. | A 不能溶解于 B 中 | ||
| C. | B 的沸点高于 C 的沸点 | D. | A 和 C 不可能发生氧化还原反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com