

分析 (1)①化学平衡常数是指:一定温度下,可逆反应到达平衡时,生成物浓度系数次幂乘积与反应物浓度系数次幂乘积的比;
②正反应为熵减,焓减反应,△H-T△S<0反应自发进行;
③反应到达平衡状态时,各组分的物质的量保持不变;
④反应进行至20min时,瞬间O2的物质的量增大了0.01mol,SO2、SO3的物质的量不变,而后SO2、O2的物质的量减小,SO3物质的量增大,直到建立新平衡;
(2)①先加热催化剂再滴入浓硫酸,能保证产生的二氧化硫尽可能多的转化为三氧化硫;
②根据温度升高,反应速率加快,产生二氧化硫的速率过快,在装置Ⅱ中来不及转化为三氧化硫;
③根据S元素守恒计算消耗的物质的量,进而计算转化率.
解答 解:(1)①2SO2(g)+O2(g)?2SO3(g)的平衡常数表达式K=$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})×c({O}_{2})}$,
故答案为:$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})×c({O}_{2})}$;
②在反应2SO2(g)+O2 (g) ?2SO3(g)中,△S<0,△H<0,但焓变影响较大,熵变影响较小,当温度较低时△G=△H-T△S<0,反应可以自发,
?2SO3(g)中,△S<0,△H<0,但焓变影响较大,熵变影响较小,当温度较低时△G=△H-T△S<0,反应可以自发,
故答案为:该反应为放热反应;
③反应混合物各物质的物质的量不变化,说明反应处于平衡状态,由图可知在15-20min和25-30min出现平台,各组分的物质的量不变,反应处于平衡状态,
故答案为:15-20min、25-30min;
④反应进行至20min时,瞬间O2的物质的量增大了0.01mol,SO2、SO3的物质的量不变,而后SO2、O2的物质的量减小,SO3物质的量增大,直到建立新平衡,故改变条件为:增大了0.01molO2,
故答案为:增大了0.01molO2;
(2)①为保证产生的二氧化硫尽可能多的转化为三氧化硫,应先加热催化剂再滴入浓硫酸,故答案为:先加热Ⅱ处催化剂;
②温度升高,反应速率加快,产生二氧化硫的速率过快,在装置Ⅱ中来不及转化为三氧化硫,所以二氧化硫的转化率减小,故答案为:减小;
③n mol Na2SO3粉末与足量浓硫酸反应生成nmol二氧化硫,当反应结束时,Ⅲ处增重的部分为未反应的二氧化硫,则转化了的二氧化硫的质量为:(64n-m)g,所以实验中SO2的转化率为$\frac{(64n-m)g}{64ng}$×100%=$\frac{64n-m}{64}$×100%,
故答案为:$\frac{64n-m}{64}$×100%.
点评 本题考查反应进行的方向、平衡状态的判断、平衡常数的概念、反应条件的控制、化学方程式的计算等,题目具有一定的综合性,需要学生具备扎实的基础,难度中等.


 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案科目:高中化学 来源: 题型:选择题
 如图是收集某气体的装置.由实验装置推测该气体的有关性质可能正确的是( )
如图是收集某气体的装置.由实验装置推测该气体的有关性质可能正确的是( )| 选项 | A | B | C | D |
| 密度比空气 | 大 | 大 | 小 | 小 |
| 溶于水中所得溶液的pH | >7 | <7 | >7 | <7 |
| 在水中的溶解性 | 大 | 小 | 大 | 小 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 科研生产中常涉及碳的化合物.请回答下列问题:
科研生产中常涉及碳的化合物.请回答下列问题:| 反应时间/min | N[CO(g)]mol | N[H2O(g)]mol |
| 0 | 1.8 | 0.9 |
| t1 | 1.2 | |
| t2 | y | 0.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{2b-a}{20}$ | B. | 2b-a | C. | 5b-$\frac{5a}{2}$ | D. | 10b-5a |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
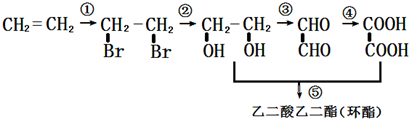
 ;
; +H2O,;
+H2O,; .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com