
| A、[H+]随着温度的升高而降低 |
| B、在35℃时,[H+]>[OH-] |
| C、水的电离程度 α(25℃)>α(35℃) |
| D、[OH-]随温度升高而增大 |


科目:高中化学 来源: 题型:
| 第Ⅰ组 | 第Ⅱ组 | 第Ⅲ组 | |
| 甲 | BaCl2 | Fe | Cu(NO3)2 |
| 乙 | Fe2O3 | K2SO4 | H2SO4 |
| 丙 | Zn | NaOH | MgCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、容器内压强P:P甲=P丙>2P乙 |
| B、SO3的质量m:m甲=m丙>2m乙 |
| C、平衡常数:K甲=K丙=K乙 |
| D、反应放出或吸收热量的数值Q:Q甲+Q丙>197kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、烃基与羧基直接相连的化合物叫做羧酸 |
| B、饱和链状羧酸的组成符合CnH2nO2 |
| C、羧酸在常温下都能发生酯化反应 |
| D、羧酸的官能团是-COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
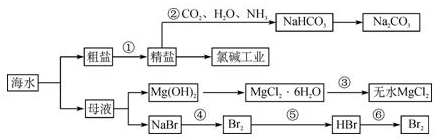
| A、步骤④、⑤、⑥反应中,溴元素均被氧化 | ||
B、除去粗盐中的S
| ||
| C、步骤②中,应先通CO2,再通NH3 | ||
| D、步骤③可将MgCl2?6H2O晶体在空气中直接加热脱水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、第三周期元素的离子半径从左到右依次减小 |
| B、HCl、PCl3、N2、CO2分子中所有原子都满足最外层8电子的结构 |
| C、晶体内可以不存在化学键,也可以同时存在离子键、极性键和非极性键 |
| D、若某离子化合物X2Y3中X3+和Y2-的电子层结构相同,则X、Y两元素的原子序数之差一定为6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com