
����Ŀ��������G������ʹ������ҩ�����ã���ϳ�·�����£�

��1��E�й����ŵ�����Ϊ____��____��
��2��B��C��E��F�ķ�Ӧ���ͷֱ�Ϊ____��____��
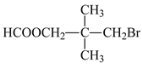
��3��M�Ľṹ��ʽΪ____��
��4��д��ͬʱ��������������C��һ��ͬ���칹��Ľṹ��ʽ��____��
���ܷ���������Ӧ��Ҳ�ܷ���ˮ�ⷴӦ��
����NaOH��Һ���Ⱥ����ò���֮һ�����ֻ�ѧ������ͬ���⣬����������Ʒ�Ӧ��
��5����д������ϩ����ϩ��PPh3Ϊԭ���Ʊ�(CH3)2C��CH��CH��C(CH3)2�ĺϳ�·������ͼ�����Լ����ã��ϳ�·������ͼ����������ɣ�____��
���𰸡����� ̼̼˫�� ������Ӧ ȡ����Ӧ 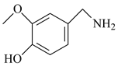
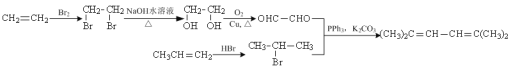
��������
A��HBr����ȡ����Ӧ����B��B����������Ӧ����C������CD�ṹ��ʽ�仯֪��C��CH3CH2OH����������Ӧ����D��D����ȡ����Ӧ����E��E����ˮ�ⷴӦȻ���ữ�õ�F������FG�ṹ��ʽ����֪��F�������ķ�Ӧ����G��M�ṹ��ʽΪ ��
��
(5)���ϳ�(CH3)2C��CH��CH��C(CH3)2�������кϳ�M����Ϣ��֪����ҪOHCCHO��![]() ��PPh3��K2CO3�Ĵ�����������(CH3)2C��CH��CH��C(CH3)2��������ϩ����ϩ�ֱ�ϳ�OHCCHO��
��PPh3��K2CO3�Ĵ�����������(CH3)2C��CH��CH��C(CH3)2��������ϩ����ϩ�ֱ�ϳ�OHCCHO��![]() ���ɡ�
���ɡ�
(1)E�Ľṹ��ʽΪ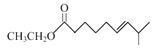 �����еĹ����ŵ�����Ϊ������̼̼˫����
�����еĹ����ŵ�����Ϊ������̼̼˫����
(2)B��C��������������Ӧ��E��F������������ˮ�ⷴӦ����ȡ����Ӧ��
(3)�ɷ���֪M�Ľṹ��ʽΪ ��
��
(4)C�Ľṹ��ʽΪ![]() ����ͬ���칹������������ǣ����ܷ���������Ӧ��Ҳ�ܷ���ˮ�ⷴӦ��˵�����ӽṹ�к���ȩ����HCOO-������Br����Ҳ�ܷ���ˮ�ⷴӦ������NaOH��Һ���Ⱥ����ò���֮һ�����ֻ�ѧ������ͬ���⣬����������Ʒ�Ӧ��˵��ˮ�����ķ��ӽṹ�к��д��ǻ����������ֻ�ѧ������ͬ���⣬˵��ˮ������в������ٺ���ȩ������˵��ͬ���칹��ṹ��ֻ�ܺ���HCOO-���ҽṹ�Գ��Խ�ǿ��������һ��̼ԭ���ϲ�����H��������������ͬ���칹��Ľṹ��ʽ��
����ͬ���칹������������ǣ����ܷ���������Ӧ��Ҳ�ܷ���ˮ�ⷴӦ��˵�����ӽṹ�к���ȩ����HCOO-������Br����Ҳ�ܷ���ˮ�ⷴӦ������NaOH��Һ���Ⱥ����ò���֮һ�����ֻ�ѧ������ͬ���⣬����������Ʒ�Ӧ��˵��ˮ�����ķ��ӽṹ�к��д��ǻ����������ֻ�ѧ������ͬ���⣬˵��ˮ������в������ٺ���ȩ������˵��ͬ���칹��ṹ��ֻ�ܺ���HCOO-���ҽṹ�Գ��Խ�ǿ��������һ��̼ԭ���ϲ�����H��������������ͬ���칹��Ľṹ��ʽ�� ��
��
(5)���ϳ�(CH3)2C��CH��CH��C(CH3)2�������кϳ�M����Ϣ��֪����ҪOHCCHO��![]() ��PPh3��K2CO3�Ĵ�����������(CH3)2C��CH��CH��C(CH3)2��������ϩ��Br2�ļӳɲ���BrCH2CH2Brˮ���õ�HOCH2CH2OH��HOCH2CH2OH�ٴ��������ɵõ�OHCCHO����
��PPh3��K2CO3�Ĵ�����������(CH3)2C��CH��CH��C(CH3)2��������ϩ��Br2�ļӳɲ���BrCH2CH2Brˮ���õ�HOCH2CH2OH��HOCH2CH2OH�ٴ��������ɵõ�OHCCHO����![]() ���ɱ�ϩ��HBr�����ӳɷ�Ӧ�õ��������ϳ�·������ͼΪ
���ɱ�ϩ��HBr�����ӳɷ�Ӧ�õ��������ϳ�·������ͼΪ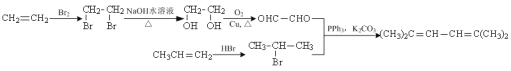 ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪���л��� A �IJ���������������һ�����ҵ�ʯ�ͻ�����չˮƽ��B �� D �����������ֳ������л������ A Ϊ��Ҫԭ�Ϻϳ�������������ϳ�·����ͼ 1 ��ʾ��

��1��B �����й����ŵ�������____����Ӧ�ٵķ�Ӧ������____��Ӧ��
��2����Ӧ�ڵĻ�ѧ����ʽ��____����Ӧ�ܵĻ�ѧ����ʽ��____��
��3��E �dz����ĸ߷��Ӳ��ϣ�E �Ľṹ��ʽ��____��
��4��ijͬѧ����ͼ 2 ��ʾ��ʵ��װ����ȡ��������������ʵ��������Թܼ����ϲ�Ϊ���ġ�������ˮ����״Һ�塣ʵ��ʱ�����б���̼������Һ�������ǣ�����ĸ��____��
A���к�������Ҵ�
B���к����Ტ���ղ����Ҵ�
C�������������ɣ���������
D�����������ڱ���̼������Һ�е��ܽ�ȱ���ˮ�и�С�������ڷֲ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ�о�С��̽����������Ի�ѧ��ӦmA(g)+nB(g) pC(g)�����ʺ�ƽ���Ӱ��ͼ�����£������ж���ȷ����

A.��ͼ1��֪��![]() ���÷�Ӧ����ӦΪ���ȷ�Ӧ
���÷�Ӧ����ӦΪ���ȷ�Ӧ
B.��ͼ2��֪���÷�Ӧ![]()
C.ͼ3�У���3�ķ�Ӧ����:v��>v��
D.ͼ4�У���![]() ����a����һ��ʹ���˴���
����a����һ��ʹ���˴���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Fenton�������ڴ������ѽ����л���Ĺ�ҵ��ˮ�������ں�pH��Fe2+Ũ�ȵķ�ˮ�м���H2O2�����������ǻ����ɻ�������������Ⱦ������ø÷��������л���Ⱦ��p��CP������p��CP�ij�ʼŨ����ͬ���㶨ʵ���¶���298K��313K����ʵ�顣ʵ����p��CP��Ũ����ʱ��仯�Ĺ�ϵ��ͼ��ʾ������˵������ȷ���ǣ�������

A.�����ɵã����ⷴӦ��50��150s�ڵķ�Ӧ���ʣ�v��pCP����8.0��10��6molL��1s��1
B.�����¶ȣ������ڼӿ콵�ⷴӦ���ʣ����¶ȹ��߷�Ӧ�����ֻ����
C.��Ŀ��Ϊ̽����Һ��pH�Խ��ⷴӦ���ʵ�Ӱ��
D.298K�£��л���p��CP��������pH��10ʱ��pH��3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ϳɰ���ҵ�漰����ȼ�ϵ���������Ҫ�о�CO2��CO֮���ת����Ϊ��Ū������ɣ���һ������CO2������̼������ɱ���ܱ������з�Ӧ��C(s)��CO2(g) ![]() 2CO(g) H�����ѹǿ���¶ȶ�CO��CO2��ƽ����ɵ�Ӱ����ͼ��ʾ���ش��������⣺
2CO(g) H�����ѹǿ���¶ȶ�CO��CO2��ƽ����ɵ�Ӱ����ͼ��ʾ���ش��������⣺

��1��p1��p2��p3�Ĵ�С��ϵ��________��ͼ��a��b��c�����Ӧ��ƽ�ⳣ����С��ϵ��______________________��
��2��һ�������£���CO2������̼��Ӧ����ƽ����ϵ�м���H2���ʵ������������з�Ӧ��������Ӧ1��CO(g)��3H2(g) ![]() CH4(g)��H2O(g) H1= a kJ/mol
CH4(g)��H2O(g) H1= a kJ/mol
��Ӧ2��CO(g)��H2O(g) ![]() CO2(g)��H2(g) H2= b kJ/mol
CO2(g)��H2(g) H2= b kJ/mol
�� �������̼��������Ӧת��Ϊ�����ˮ�������Ȼ�ѧ����ʽ��____________��
�� ��֪298 Kʱ��ػ�ѧ����������Ϊ��
��ѧ�� | H��H | O��H | C��H |
|
E/��kJ��mol-1�� | 436 | 465 | 413 | 1076 |
����ݼ��ܼ��㣬H1=________________����Ӧ1�Է����е�������___________���������ϸ��¶��������ϵ��¶������������¶�����
��3��һ�������£�CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ��H3����̶��ݻ�Ϊ1 L���ܱ������г���2 mol CO2��6 mol H2��һ��ʱ���ﵽƽ��״̬�����CH3OH(g)�����ʵ���Ϊ1mol����������¸÷�Ӧ�Ļ�ѧƽ�ⳣ��K =_________���÷�����ʾ��������ʼʱ����2 mol CH3OH(g) ��2 mol H2O(g)�ﵽ��ͬƽ��״̬ʱ��CH3OH��ת����Ϊ_______����ƽ����ٳ���4 mol��N2����c(CO2)��ԭƽ��Ƚ���_________��������������������С��������������
CH3OH(g)+H2O(g) ��H3����̶��ݻ�Ϊ1 L���ܱ������г���2 mol CO2��6 mol H2��һ��ʱ���ﵽƽ��״̬�����CH3OH(g)�����ʵ���Ϊ1mol����������¸÷�Ӧ�Ļ�ѧƽ�ⳣ��K =_________���÷�����ʾ��������ʼʱ����2 mol CH3OH(g) ��2 mol H2O(g)�ﵽ��ͬƽ��״̬ʱ��CH3OH��ת����Ϊ_______����ƽ����ٳ���4 mol��N2����c(CO2)��ԭƽ��Ƚ���_________��������������������С��������������
��4����ͼ�Ǽ״�ȼ�ϵ�ع�����ʾ��ͼ������A��B��D��Ϊʯī�缫��CΪͭ�缫������һ��ʱ��Ͽ�K����ʱA��B�����ϲ��������������ͬ��

�����и����ĵ缫��ʽΪ_______________������C���ĵ缫��ӦʽΪ___________��
�� ����A�������������ڱ�״���µ����Ϊ__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͬ���ܱ������У������ֲ�ͬ�����Ƶõ�![]() �ֱ���д��ֽ�ˮ��ʵ�飺
�ֱ���д��ֽ�ˮ��ʵ�飺![]()
![]() ��ˮ������Ũ��
��ˮ������Ũ��![]() ��ʱ��
��ʱ��![]() �仯���¡�
�仯���¡�
��� |
| �¶� | 0 | 10 | 20 | 30 | 40 | 50 |
�� | ����I |
|
|
|
|
|
|
|
| p>�� | ����II |
|
|
|
|
|
|
|
�� | ����II |
|
|
|
|
|
|
|
����������ȷ����
A.ʵ��١��ڡ��۵Ļ�ѧƽ�ⳣ���Ĺ�ϵ��![]()
B.ʵ��ٱ�ʵ������õ�![]() ��Ч�ʸ�
��Ч�ʸ�
C.ʵ����¶ȣ�![]()
D.ʵ���ǰ20min��ƽ����Ӧ����![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ִ�����п�����з���������������Ҫ��Ӧ������˵����ȷ����( )
�� 2ZnS(s) + 3O2(g)=2ZnO(s)+2SO2(g) ��H1=a kJ��mol-1
�� 2C(s) +O2(g)=2CO(g) ��H2=b kJ��mol-1
�� ZnO(s) +CO(g)=Zn(g) +CO2(g) ��H3=c kJ��mol-1
A.����������Ӧ�У�ֻ�Т��Ƿ��ȷ�Ӧ
B.��Ӧ�ڵ������ǽ�Ϊ��Ӧ���ṩ��ԭ��
C.��Ӧ ZnS(s)+C(s)+2O2(g)=Zn(g)+SO2(g)+CO2(g)�ġ�H=![]() (a+b+2c) kJ��mol-1
(a+b+2c) kJ��mol-1
D.̼��ȼ����Ϊ![]() b kJ��mol-1
b kJ��mol-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ݻ���Ϊ![]() �ĺ����ܱ������У���ʼʱ������
�ĺ����ܱ������У���ʼʱ������![]() �����¶ȡ�
�����¶ȡ�![]() ����Ϊʵ����������������
����Ϊʵ����������������![]() �ķֽ�ʵ��
�ķֽ�ʵ��![]() ��ӦΪ
��ӦΪ![]() ����õĽ����ͼ��ʾ��
����õĽ����ͼ��ʾ��![]() ���ߢ��ʾ������ͬʱ����δ�ﵽ��ѧƽ��ʱ
���ߢ��ʾ������ͬʱ����δ�ﵽ��ѧƽ��ʱ![]() ��ת����
��ת����![]()
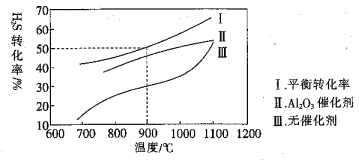
����˵����ȷ����( )
A.�¶����ߣ�![]() �ֽ����������
�ֽ����������![]() �ĺ�������
�������
B.�����ߢ��֪������![]() �����
�����![]() ��ƽ��ת����
��ƽ��ת����
C.![]() ʱ��ts��ﵽƽ�⣬��
ʱ��ts��ﵽƽ�⣬��![]() ����������Ϊ
����������Ϊ![]()
D.Լ![]() ʱ�����ߢ��غϣ�˵��
ʱ�����ߢ��غϣ�˵��![]() ���ܼ���ʧȥ������
���ܼ���ʧȥ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ⶨ0.1 mol��L-1 Na2SO3��Һ�������ٽ��¹����е�pH���������¡�
ʱ�� | �� | �� | �� | �� |
�¶�/�� | 25 | 30 | 40 | 25 |
pH | 9.66 | 9.52 | 9.37 | 9.25 |
ʵ������У�ȡ�٢�ʱ�̵���Һ�����������ữ��BaCl2��Һ���Ա�ʵ�飬�ܲ�����ɫ�����ࡣ
����˵������ȷ����
A. Na2SO3��Һ�д���ˮ��ƽ����![]() +H2O
+H2O![]()
![]() +OH
+OH
B. ����pH������ͬ��������![]() Ũ�ȼ�С��ɵ�
Ũ�ȼ�С��ɵ�
C. �١����Ĺ��������¶Ⱥ�Ũ�ȶ�ˮ��ƽ���ƶ������Ӱ��һ��
D. ��������Kwֵ���
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com