
 )和抗癫痫药物H(
)和抗癫痫药物H(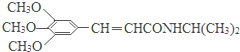 )的路线如图(部分反应略去条件和试剂):
)的路线如图(部分反应略去条件和试剂):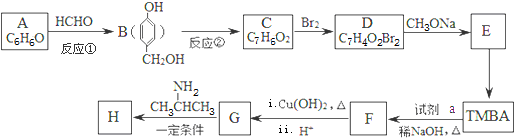
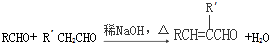 (R、R′表示烃基或氢)
(R、R′表示烃基或氢)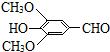 ,试剂a的分子式是C2H4O.
,试剂a的分子式是C2H4O. +2Br2→
+2Br2→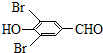 +2HBr.
+2HBr.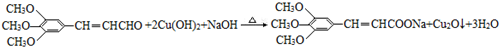 .
.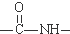 )有类似酯基水解的性质,写出抗癫痫病药物H与足量NaOH溶液发生反应的化学方程式
)有类似酯基水解的性质,写出抗癫痫病药物H与足量NaOH溶液发生反应的化学方程式 +NaOH→
+NaOH→ +H2NCH(CH3)2.
+H2NCH(CH3)2. 分析 A的分子式为C6H6O,而能与HCHO反应生成B,由B的结构可知A为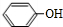 ;B的分子式为C7H8O2,生成的C的分子式为C7H6O2,则反应②为羟基氧化为醛基,则C的结构简式为:
;B的分子式为C7H8O2,生成的C的分子式为C7H6O2,则反应②为羟基氧化为醛基,则C的结构简式为: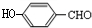 ,C与溴发生酚羟基邻位取代生成D为
,C与溴发生酚羟基邻位取代生成D为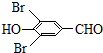 ,由信息I中的反应可知,D与甲醇钠反应生成E为
,由信息I中的反应可知,D与甲醇钠反应生成E为 .由H的结构可知G为
.由H的结构可知G为 ,逆推可知F为
,逆推可知F为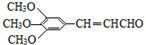 ,结合信息II可知,TMBA与CH3CHO在碱性条件下生成F,据此解答.
,结合信息II可知,TMBA与CH3CHO在碱性条件下生成F,据此解答.
解答 解:A的分子式为C6H6O,而能与HCHO反应生成B,由B的结构可知A为 ;B的分子式为C7H8O2,生成的C的分子式为C7H6O2,则反应②为羟基氧化为醛基,则C的结构简式为:
;B的分子式为C7H8O2,生成的C的分子式为C7H6O2,则反应②为羟基氧化为醛基,则C的结构简式为: ,C与溴发生酚羟基邻位取代生成D为
,C与溴发生酚羟基邻位取代生成D为 ,由信息I中的反应可知,D与甲醇钠反应生成E为
,由信息I中的反应可知,D与甲醇钠反应生成E为 .由H的结构可知G为
.由H的结构可知G为 ,逆推可知F为
,逆推可知F为 ,结合信息II可知,TMBA与CH3CHO在碱性条件下生成F,
,结合信息II可知,TMBA与CH3CHO在碱性条件下生成F,
(1)由上述分析可知,A为 ,名称为苯酚,C的结构简式为:
,名称为苯酚,C的结构简式为: C分子中含氧官能团的名称是:羟基、醛基,
C分子中含氧官能团的名称是:羟基、醛基,
故答案为:苯酚;羟基、醛基;
(2)反应①的反应物为苯酚和甲醛,生成物为B,对比结构可知反应①为加成反应;反应②为醇羟基氧化为醛基,
故答案为:加成反应;氧化反应;
(3)由上述分析可知,E的结构简式为 ,试剂a为CH3CHO,的分子式是C2H4O,
,试剂a为CH3CHO,的分子式是C2H4O,
故答案为: ;C2H4O;
;C2H4O;
(4)C→D的化学方程式是: +2Br2→
+2Br2→ +2HBr,
+2HBr,
故答案为: +2Br2→
+2Br2→ +2HBr;
+2HBr;
(5)D为 ,属于芳香族酯类化合物一定含有-OOCH,2个Br原子相邻时,-OOCH有2种位置,2个Br原子相间时,-OOCH有3种位置,2个Br原子相对时,-OOCH有1种位置,故共有2+3+1=6种,
,属于芳香族酯类化合物一定含有-OOCH,2个Br原子相邻时,-OOCH有2种位置,2个Br原子相间时,-OOCH有3种位置,2个Br原子相对时,-OOCH有1种位置,故共有2+3+1=6种,
故答案为:6;
(6)F为 ,与新制Cu(OH)2悬浊液发生反应的化学方程式是:
,与新制Cu(OH)2悬浊液发生反应的化学方程式是: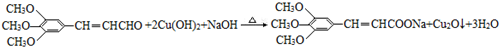 ,
,
故答案为: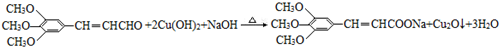 .
.
(7)抗癫痫病药物H含有酰胺键,在NaOH条件下发生水解,则反应的化学方程式为: +NaOH→
+NaOH→ +H2NCH(CH3)2,
+H2NCH(CH3)2,
故答案为: +NaOH→
+NaOH→ +H2NCH(CH3)2.
+H2NCH(CH3)2.
点评 本题考查有机合成与推断、同分异构体的判断、有机反应类型、化学方程式的书写,是对有机化学基础的综合考查,注意充分利用TMBA与H的结构、有机物分子式推断,较好的考查学生分析推理能力,难度中等.


科目:高中化学 来源: 题型:实验题
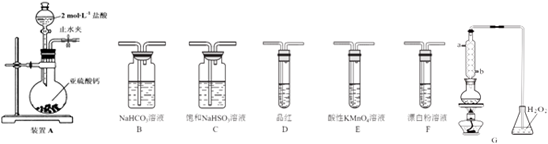
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢的五种同位素 | B. | 五种氢元素 | ||
| C. | 都不带电荷的粒子 | D. | 氢元素的五种不同粒子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
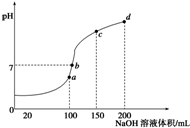 常温下,向100mL0.1mol/LNH4HSO4溶液中滴加0.1mol/L的NaOH溶液,所得溶液PH与NaOH溶液体积的关系曲线如图所示,下列说法正确的是( )
常温下,向100mL0.1mol/LNH4HSO4溶液中滴加0.1mol/L的NaOH溶液,所得溶液PH与NaOH溶液体积的关系曲线如图所示,下列说法正确的是( )| A. | a、b、c、d四个点中,水的电离程度最大的是d | |
| B. | a点溶液中:c(NH3•H2O)+c(H+)═c(OH-) | |
| C. | b点溶液中:c(Na+)+c(NH4+)═2c(SO42-) | |
| D. | c点溶液中:c(Na+)═c(SO42-)+c(NH4+)+c(NH3•H2O) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
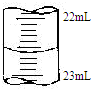 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 25.00 | 0.50 | 20.40 |
| 第二次 | 25.00 | 4.00 | 24.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
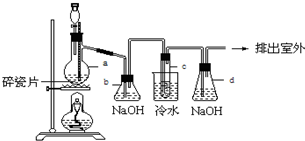
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
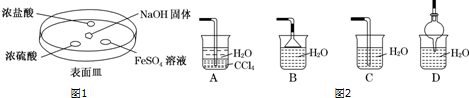
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
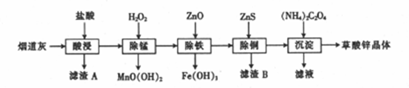
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| 开始沉淀时的pH | 1.9 | 6.5 | 4.2 | 5.4 |
| 完全沉淀时的pH | 3.3 | 9.7 | 6.7 | 8.2 |
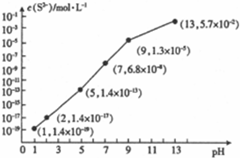
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com