
【化学---选修3物质结构与性质】15分
卤族元素的单质和化合物很多,一氯化碘(ICl)、三氯化碘(ICl3),由于它们的性质与卤素相似,因此被称为卤素互化物。请利用所学物质结构与性质的相关知识回答下列问题:
(1)卤族元素位于周期表的 区 I-的最外层电子排布式为
(2)已知高碘酸有两种形式,化学式分别为H5IO6 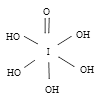 和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱: H5IO6 HIO4.(填“>”、“<”或“=”)。H5IO6中α键与π键的个数比为 。
和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱: H5IO6 HIO4.(填“>”、“<”或“=”)。H5IO6中α键与π键的个数比为 。
(3)已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列 式发生。A.CsICl2=CsCl+ICl B.CsICl2 ="CsI" +Cl2
(4)用海带制碘时,生成的粗碘中常混有ICl,可加入KI加热升华提纯,
发生化学反应的化学方程式为
(5)ClO2—的空间构型为 型,中心氯原子的杂化轨道类型为 ,
(6)已知CaF2晶体(见图)的密度为ρg/cm3.NA为阿伏加德罗常数,距离最近且相等的两个Ca2+核间距为a cm,则CaF2的摩尔质量为 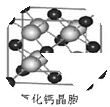
15分)(1)P区 ;5s25p6;(2)H5IO6 < HIO4. 11:1;(3) A;
(4)ICl+KI=I2+KCl ;(5)V型, sp3 ;(6)摩尔质量为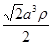 g/mol
g/mol
解析试题分析:(1)卤族元素位于周期表的p区; 碘元素是第五周期第VIIA的元素。I-的最外层电子排布式为5s25p6;(2)高碘酸有两种形式,化学式分别为H5IO6 和HIO4,前者为五元酸,后者为一元酸。酸的元数取决于羟基的个数,而酸性强弱,则取决于非羟基O原子的个数。非羟基O原子的个数越多,酸的酸性就越强,所以酸性H5IO6<HIO4。H5IO6中α键是11个,π键是1个,所以二者的个数比为11:1,错误;(3)已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,物质的稳定性:CsCl>CsI,即晶格能CsCl>CsI,所以它按下列A式发生。(4)用海带制碘时,生成的粗碘中常混有ICl,可加入KI加热升华提纯,发生化学反应的化学方程式为ICl+KI=I2+KCl ;(5)ClO2—的空间构型为V型,中心氯原子的杂化轨道类型为sp3杂化;(6)根据CaF2晶体结构可知:在一个晶胞中含有F-:8; Ca2+:8×1/8+6×1/2=4;所以一个晶胞中含有4个CaF2。晶体中距离最近且相等的两个Ca2+核间距为a cm,则晶胞的边长是L= ;晶体的密度是ρ=
;晶体的密度是ρ= g/cm3,所以M=
g/cm3,所以M=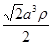 。
。
考点:考查元素在周期表中的位置、原子核外电子排布、物质酸性强弱比较、物质分子内的化学键的种类及个数、分子的空间构型、原子的杂化、物质反应方程式的书写及摩尔质量的计算的知识。


 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案科目:高中化学 来源: 题型:单选题
下列物质的分离方法不正确的是
| A.用过滤的方法除去食盐中泥沙 |
| B.用蒸馏的方法将海水淡化 |
| C.用酒精萃取碘水中的碘单质 |
| D.用加热的方法除去碳酸钠中的碳酸氢钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
(9分)甲、丙、丁是由短周期元素组成的物质,它们之间存在如下转化关系。
甲 + H2O → 丙 + 丁
(1)转化关系中所涉及的反应为非氧化还原反应。
①若甲是一种钠盐,丁为两性氢氧化物,则甲的化学式为 ,丁的酸式电离方程式为 。
②若甲是由N和Cl元素组成的化合物,其分子结构模型如图所示,丙具有漂白性。则甲中Cl元素的化合价是 ,丁与H2O有相同的电子总数,则丁的电子式为 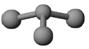
(2)转化关系中所涉及的反应为氧化还原反应。
①若甲和丙是同主族元素组成的单质,且组成甲的元素位于第三周期,此反应的离子方程式是 。
②若丙和丁都可在一定条件下还原CuO,此反应的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
(6分)下图所示各物质是由短周期部分元素组成的单质或其化合物,图中部分反应条件及物质未列出。已知:A、C、D、F均为单质,C、E、F、G常温下是气体,J为白色沉淀,既能溶于B,又能溶于E;物质B、G可以使湿润的红色石蕊试纸变蓝,且B的焰色反应呈黄色。反应④是化肥工业的重要反应。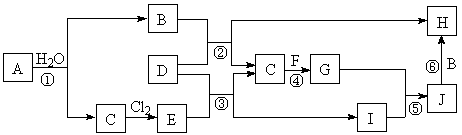
请回答下列问题:
(1)A的元素在元素周期表中的位置是 ,物质B的电子式为 。
(2)上述反应①~⑥中,属于化合反应的是 ,反应⑤的离子方程式为 。
(3)在I的水溶液滴加B溶液至过量的过程中,所观察到的现象为 。
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
(12分)图中X、Y、Z为单质,其他为化合物,它们之间存在如下转化关系(部分产物已略去)。其中,A俗称磁性氧化铁,E是不溶于水的酸性氧化物,能与氢氟酸反应。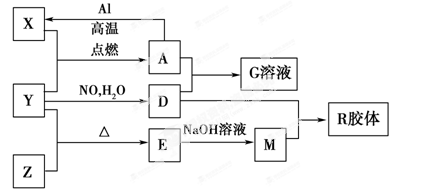
回答下列问题:
(1)组成单质Y的元素在周期表中的位置是________;M中存在的化学键类型为________;R的化学式是________。
(2)一定条件下,Z与H2反应生成ZH4,ZH4的电子式为______。
(3)已知A与1 mol Al反应转化为X时(所有物质均为固体),放出a kJ热量。写出该反应的热化学方程式:___________________。
(4)写出A和D的稀溶液反应生成G的离子方程式:__________。
(5)向含4mol D的稀溶液中,逐渐加入X粉末至过量。假设生成的气体只有一种,请在坐标系中画出n(X2+)随n(X)变化的示意图,并标出n(X2+)的最大值。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
化学反应伴随能量变化,下列说法中错误的是
| A.TNT(炸药)爆炸时部分化学能转化为热能 |
| B.电解饱和食盐水时部分化学能转化为电能 |
| C.镁条燃烧时部分化学能转化为光能 |
| D.植物光合作用时部分光能转化为化学能 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列叙述正确的是
| A.在某反应中,当反应物具有的总能量大于生成物具有的总能量时,该反应吸热 |
| B.同温同压下,4Al(s)+3O2(g)===2Al2O3(s)在常温和点燃条件下的ΔH不同 |
| C.稀溶液中:H+(aq)+OH- (aq) ===H2O(l);ΔH=-53.7KJ/mol ,若将含0.5 mol H2SO4的浓溶液与含1 mol NaOH的溶液混合,放出的热量大于53.7kJ |
| D.由C(石墨)=== C(金刚石)△H= +1.90 kJ·mol-1 可知,金刚石比石墨稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
2007年3月,温家宝指出“优化结构、提高效益和降低消耗、保护环境”,这是我国国民经济和社会发展的基础性要求。你认为下列行为不符合这个要求的是
| A.大力发展农村沼气,将废弃的秸轩转化为清洁高效的能源 |
| B.加快太阳能、风能、生物质能、海洋能等清洁能源的开发利用 |
| C.研制开发以水代替有机溶剂的化工涂料 |
| D.将煤转化成气体燃料可以有效地减少“温室效应”的气体产生 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com