
 (不考虑空间构型).
(不考虑空间构型). 分析 (1)根据电子排布式的书写方法,Cu2+基态核外电子排布式为[Ar]3d9;
(2)乙醛中甲基上的C形成4条σ键,无孤电子对,因此采取sp3杂化类型,醛基中的C形成3条σ键和1条π键,无孤电子对,采取sp2杂化类型;单键都为σ键,双键中有1个σ键;
(3)H2O有3个原子8个价电子,根据等电子体原理可知,与水互为等电子体的阴离子为NH2-;为分子间形成氢键促进溶解;
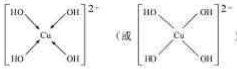
(4)配离子Cu(OH)42-的结构式 .
.
解答 解:(1)根据电子排布式的书写方法,Cu2+基态核外电子排布式为[Ar]3d9,故答案为[Ar]3d9;
(2)乙醛中甲基上的C形成4条σ键,无孤电子对,因此采取sp3杂化类型,醛基中的C形成3条σ键和1条π键,无孤电子对,采取sp2杂化类型;1个乙酸分子含有7molσ键,故答案为:sp2,sp3;7mol;
(3)H2O有3个原子8个价电子,根据等电子体原理可知,与水互为等电子体的阴离子为NH2-;H2O与CH3CHO能够互溶,除了它们都是极性分子外,还因为分子间形成氢键,故答案为:NH2-;分子间形成氢键;
(4)配离子Cu(OH)42-的结构式 ,故答案为:
,故答案为: .
.
点评 本题考查了核外电子排布式、结构式、杂化轨道类型、等电子体等基本化学术语,要求学生有扎实的基本知识,为中等难度的试题,但容易失分.


 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
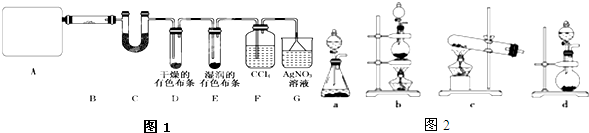
 Ⅰ.某同学为探究元素周期表中同周期元素性质的递变规律,设计了如下系列实验.
Ⅰ.某同学为探究元素周期表中同周期元素性质的递变规律,设计了如下系列实验.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
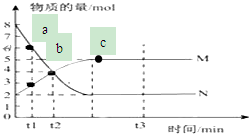 一定温度下,在容积为V L的密闭容器中进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图所示:
一定温度下,在容积为V L的密闭容器中进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素 | I1 | I2 | I3 | I4 |
| X | 500 | 4 600 | 6 900 | 9 500 |
| Y | 580 | 1 800 | 2 700 | 11 600 |
| A. | 元素X的常见化合价是+1 | |
| B. | 元素Y是ⅢA族元素 | |
| C. | 元素X与氧形成化合物时,化学式可能是X2O或X2O2 | |
| D. | 若元素Y处于第三周期,它可与冷水剧烈反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电池工作室,锂电极反应式为Li-e-═Li+ | |
| B. | 若将石墨换成铁时,电池还能继续工作 | |
| C. | 电池工作时,电解质中的ClO4-运动到电池的石墨极 | |
| D. | 正极发生了还原反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com