

分析 A用于制备氯气,加热条件下浓盐酸和二氧化锰反应生成氯气,氯气密度比空气大,可用向上排空气法在C中收集气体,D中氯气可将氯化亚铁氧化生成氯化铁,滴加KSCN溶液,D中溶液变红色,可用于检验铁离子,因氯气有毒,且与氢氧化钠溶液反应,D中氢氧化钠溶液用于吸收氯气,防止污染空气,实验结束时关闭活塞K,可用B收集多余的氯气,以此解答该题.
解答 解:(1)浓盐酸与二氧化锰在加热条件下发生反应生成氯气、氯化锰和水,化学方程式:MnO2+4 HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2 H2O,
故答案为:MnO2+4 HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2 H2O;
(2)氯气难溶于饱和食盐水,而HCl易溶于水,B处饱和食盐水是为了除去HCl,浓硫酸具有吸水作用,C处浓硫酸的作用是干燥氯气,
故答案为:除去氯气中的氯化氢气体;干燥氯气;
(3)氯气不具有漂白性,所以干燥的紫色石蕊试纸不变色;氯气和水反应生成盐酸和次氯酸,可观察到E处先变红后褪色;氯气有毒不能直接排放的空气中,用G吸收氢氧化钠溶液吸收过量的氯气,反应的方程式为:Cl2+2NaOH═NaCl+NaClO+H2O;
故答案为:仍为紫色;先变红后褪色;吸收多余的氯气;Cl2+2NaOH═NaCl+NaClO+H2O;
(4)氯气难溶于饱和食盐水,甲中H-I装置可用来收集氯气,但不能用乙装置,原因是密闭装置,气体压力大时易爆炸,
故答案为:储存多余的氯气;否;因为乙装置是一个密封装置,体积不能改变,压强增大时有危险.
点评 本题考查了氯气的制备及其性质应用,为高频考点,侧重于学生的分析、实验能力的考查,题目主要考查化学方程式的书写、装置的正误判断,明确氯气制备原理和性质是解题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 石灰水与盐酸的反应 OH-+H+═H2O | |
| B. | 氧化铜与盐酸反应 O2-+2H+═H2O | |
| C. | 铜片插入硝酸银溶液中 Cu+Ag+═Cu2++Ag | |
| D. | 碳酸钙溶于醋酸中 CaCO3+2H+═Ca2++H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ③ | C. | ③④ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制一定物质的量浓度的溶液实验中,定容时,俯视观察刻度线,会引起配制溶液的浓度偏高 | |
| B. | 分液漏斗中上层和下层液体均可以从下口流出 | |
| C. | 冷凝管使用时冷水既可以从上口进也可以从下口进 | |
| D. | 不能用丁达尔效应鉴别Fe(OH)3胶体和CuSO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 体积V/mL | ||||
| K2S2O8溶液 | 水 | KI溶液 | Na2S2O3溶液 | 淀粉溶液 | |
| ① | 10.0 | 0.0 | 4.0 | 4.0 | 2.0 |
| ② | 9.0 | 1.0 | 4.0 | 4.0 | 2.0 |
| ③ | 8.0 | Vx | 4.0 | 4.0 | 2.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,18g H2O 中含有的原子总数无法计算 | |
| B. | 在标准状况时,20mL NH3 与60mL O2所含的分子个数比为1:3 | |
| C. | 将80g NaOH 溶于1L水中,所得溶液中NaOH 的物质的量浓度为2 mol•L-1 | |
| D. | 1L 0.25mol/L H2SO4 溶液中含有6.02×1023个氧原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na | B. | FeCl3溶液 | C. | KMnO4酸性溶液 | D. | 溴水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
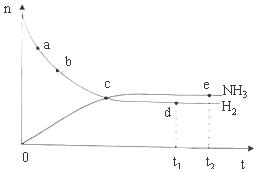 合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g)△H<0,673K,30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g)△H<0,673K,30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )| A. | 点a的正反应速率比点b的小 | |
| B. | 点c处反应达到平衡 | |
| C. | 点d(t1时刻)和点e(t2时刻)处n(N2)不一样 | |
| D. | 点d(t1时刻)和点e(t2时刻)处H2的转化率相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com