
【题目】如图所示装置,将溶液a逐滴加入固体b中,下列叙述中不正确的是( )

A.若a为浓盐酸,b为MnO2,c中盛品红溶液,则c中溶液褪色
B.若a为醋酸溶液,b为贝壳,c中盛过量澄清石灰水,则c中溶液变浑浊
C.若a为浓硫酸,b为Na2SO3固体,c中盛紫色石蕊溶液,则c中溶液变红
D.若a为浓氨水,b为生石灰,c中盛AlCl3溶液,则c中产生白色沉淀
【答案】A
【解析】
A.浓盐酸和MnO2反应需加热,而该装置没有加热,所以不能生成氯气,品红溶液不会褪色,故A错误;
B.若a为醋酸溶液,b为贝壳:2CH3COOH+CaCO3=Ca(CH3COO)2+CO2↑+H2O,产生的CO2经过c中过量澄清石灰水:CO2+Ca(OH)2(过量)=CaCO3↓+H2O,所以c中溶液变浑浊,故B正确;
C.浓硫酸和亚硫酸钠发生反应:Na2SO3+H2SO4═Na2SO4+SO2↑+H2O,二氧化硫与c中的水反应生成亚硫酸,能使c中石蕊溶液变红,但不褪色,故C正确;
D.若a为浓氨水,b为生石灰,浓氨水和CaO固体发生反应:NH3H2O+CaO═Ca(OH)2+NH3↑,c中盛AlCl3溶液,NH3与c中AlCl3溶液发生反应:3NH3+3H2O+AlCl3=Al(OH)3↓+3NH4Cl,c中产生白色沉淀,故D正确;
答案选A。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】有机物M为烃的含氧衍生物,为研究M的组成与结构,依次进行了如下实验:
实验步骤 | 解释或实验结论 |
1、升温使M汽化,测其密度是相同条件下NO的3倍。 | 由此可知M的摩尔质量为 _________ |
2、称取9.0 g M在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g | 由此可知M的分子式为 ________ |
3、通过M的红外光谱图发现该分子中含有C—C、C—H、C—O、O—H、C=O,且该物质可与碳酸钠溶液反应放出气体,1mol该物质与足量金属钠反应可得1mol氢气。 | (1)M中可与碳酸钠溶液反应放出气体的官能团的名称为:_________ |
4、M的核磁共振氢谱如图:
| (2)M中含有_______种氢原子 |
5、综上所述,可知 M的结构简式为_________。 | |
6、N的分子式为C8H8O3,为芳香族化合物,与M具有相同数目和种类的官能团,则满足条件的N的同分异构体共有____种,其中苯环上有两个取代基,遇FeCl3溶液显紫色的N的结构简式为______(写出一种即可)。 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物Y 能用于高性能光学树脂的合成,可由化合物X与2 甲基丙烯酰氯在一定条件下反应制得:
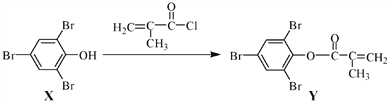
下列有关化合物X、Y 的说法正确的是
A. X 分子中所有原子一定在同一平面上
B. Y与Br2的加成产物分子中含有手性碳原子
C. X、Y均不能使酸性KMnO4溶液褪色
D. X→Y的反应为取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式不正确的是
A.苯酚与少量碳酸钠溶液的反应:![]() +CO32-→
+CO32-→![]() +HCO3-
+HCO3-
B.淀粉碘化钾溶液在空气中变蓝:4I-+O2+2H2O=2I2+4OH-
C.电解熔融氯化镁制镁:Mg2++2Cl-![]() Mg+Cl2↑
Mg+Cl2↑
D.铜与浓硝酸反应:Cu+4HNO3(浓)=Cu2++2NO3-+2NO2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物Y具有抗菌、消炎作用,可由X制得。
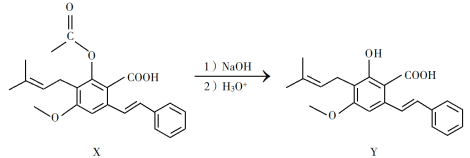
下列有关化合物X、Y的说法正确的是
A.Y与丙醇发生酯化反应可得到与X相对分子质量相同的酯
B.X、Y均能与FeCl3溶液发生显色反应
C.1 mol X与1 mol Y最多能反应的NaOH量相同
D.室温下X、Y分别与足量Br2加成的产物分子中手性碳原子数均为4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向稀硫酸和稀硝酸的混合溶液200 mL中逐渐加入铁粉,产生气体的量随铁粉质量的变化如图所示(已知硝酸只被还原为NO气体)。下列分析错误的是( )
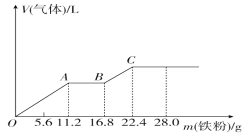
A.OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生H2
B.A点溶液中的溶质为Fe(NO3)3和H2SO4
C.原混合酸中NO3-物质的量为0.2 mol
D.原混合酸中H2SO4的物质的量浓度为2 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水中提取溴的工业流程如图:

(1)步骤I中将卤水酸化,再通入Cl2,是为了防止Cl2与碱反应,写出Cl2与碱反应的离子方程式_____。
(2)步骤I中已获得游离态的溴,步骤II又将之转变成化合态的溴,其目的是__________。
(3)实验室保存液溴时,通常在盛液溴的试剂瓶中加少量的水,这与液溴的_____性质有关(填写序号)。
A.氧化性 B.还原性 C.挥发性 D.密度比水大
(4)步骤II中将吹出的溴蒸汽用纯碱溶液吸收时还有CO2生成,写出吸收时发生反应的离子方程式:___。
(5)步骤II中通入热空气吹出的Br2用纯碱溶液吸收前先经过NaBr溶液,其目的是______________。
(6)步骤III中蒸馏出工业溴后残留液的主要溶质是_______________。
(7)步骤III中若使用硝酸酸化,缺点是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】伞形花内酯的一种制备方法如下: 下列说法不正确的是( )
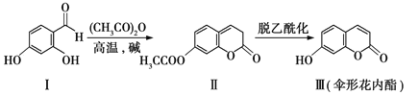
A. Ⅰ、Ⅱ、Ⅲ均能发生水解反应
B. Ⅰ、Ⅱ、Ⅲ均能与溴水反应
C. 检验化合物Ⅱ中是否混有化合物Ⅰ,可用FeCl3溶液
D. 与化合物Ⅰ官能团种类、数目均相同且含有苯环的同分异构体有5种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com