
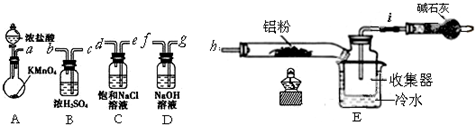


科目:高中化学 来源: 题型:
| A、0.1mol?L-1 |
| B、0.15mol?L-1 |
| C、0.2mol?L-1 |
| D、0.3mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、酸性氧化物都是非金属氧化物 |
| B、一种元素可能有多种氧化物,但同种化合价只对应一种氧化物 |
| C、丁达尔效应可用于区别溶液与胶体,云、雾均能产生丁达尔效应 |
| D、熔融状态能导电的物质一定是离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向未知溶液中加入硝酸银溶液,有白色沉淀产生 |
| B、向未知溶液中加入硝酸银溶液,有白色沉淀产生,加入盐酸后.沉淀不消失 |
| C、向未知溶液中加入稀硝酸酸化后,再加入硝酸银溶液,有白色沉淀产生 |
| D、向未知溶液中加入稀盐酸酸化后,再加入硝酸银溶液,有白色沉淀产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 操作 | 现象 | 结论 | |
| A | 无色溶液中滴加氯水和CCl4,振荡、静置 | 下层溶液显紫色 | 原溶液中有I- |
| B | 向溶液X中先滴加稀硝酸,再滴加Ba(NO3)2溶液 | 出现白色沉淀 | 溶液X中一定含有SO42- |
| C | 用洁净铂丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 原溶液中有Na+、无K+ |
| D | 滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无NH4+ |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
 小红在帮实验员整理化学试剂时,发现一瓶标签破损的无色溶液,标签严重破损,只能隐约看到一部分(如图).下列说法不正确的是( )
小红在帮实验员整理化学试剂时,发现一瓶标签破损的无色溶液,标签严重破损,只能隐约看到一部分(如图).下列说法不正确的是( )| A、该有机物的分子式一定为C3H6O2 |
| B、在酸性条件下水解生成两种有机产物的相对分子质量可能相等 |
| C、该有机物在碱性条件下可水解更完全 |
| D、该有机物肯定能发生银镜反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
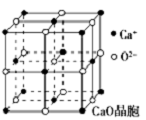 可以由下列反应合成三聚氰胺:CaO+3C
可以由下列反应合成三聚氰胺:CaO+3C
| ||
| ||
 )俗称“蛋白精”.动物摄入三聚氰胺和三聚氰酸 (
)俗称“蛋白精”.动物摄入三聚氰胺和三聚氰酸 (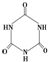 )后,三聚氰酸与三聚氰胺分子相互之间通过
)后,三聚氰酸与三聚氰胺分子相互之间通过查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com