
科目:高中化学 来源: 题型:填空题

| 温度/℃ | 400 | 500 | 830 |
| 平衡常数K | 10 | 9 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
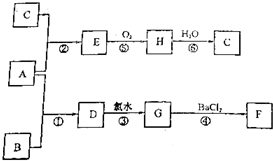
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 39g苯中含有C═C键数为1.5NA | |
| B. | 0.5molFeBr2与标准状况下33.6L氯气反应时转移电子数为3NA | |
| C. | 1L0.5mol•L-1的NaClO溶液中含有的ClO-离子数为0.5NA | |
| D. | 常温常压下,14g由C2H4和C3H6组成的混合气体中含有的原子总数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
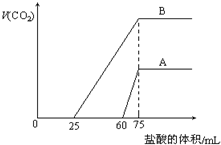 取来两份等浓度的NaOH溶液A和B,每份10mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.2mol/L的盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如图所示,试回答下列问题:
取来两份等浓度的NaOH溶液A和B,每份10mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.2mol/L的盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如图所示,试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲中反应达到平衡时,Q1=Q | |
| B. | 达到平衡后,甲中C的体积分数比乙大 | |
| C. | 达到平衡后,再向乙中加入0.25molA、0.75molB、1.5molC,平衡向生成C的方向移动 | |
| D. | 乙中的热化学反应方程式为2C(g)?A(g)+3B(g)△H=+Q2kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
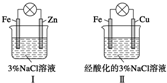
| A. | Ⅰ中不能形成原电池 | |
| B. | Ⅱ中负极反应是Fe-3e-═Fe3+ | |
| C. | Ⅱ中正极反应是O2+2H2O+4e-═4OH- | |
| D. | Ⅱ中加入少量K3[Fe(CN)6]溶液,有蓝色沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com