
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
分析 先根据烷烃的条件,确定烷烃的分子式,然后再根据官能团位置异构确定烯烃的同分异构体.
解答 解:第一步:确定该烷烃碳原子个数
①主链为4个碳原子的烷烃,其支链只能是甲基(不可能是乙基,否则主链超过4个碳原子).
②主链为4个碳原子的烷烃,支链数最多4个(下面的0,是指该物质只有一种,没有同分异构体)
甲基的个数 同分异构体
1个 0
2个 2
3个 0
4个 0
③结论:该烷烃总共有6个碳原子,
第二步:分析烯烃的同分异构体数目
①双键在1号位,有以下3种
C=C-C-C
1 2 3 4
2-乙基丁烯、2,3-二甲基丁烯、3,3-二甲基丁烯
②双键在2号位,有1种
C-C=C-C
1 2 3 4
2,3-二甲基-2-丁烯
结论:共有4种.
故选B.
点评 本题主要考查了同分异构体的写法,能熟练书写1-6个碳的碳链异构;常规的书写方法:碳链异构→位置异构→类别异构.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:实验题
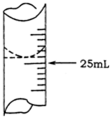 欲测定某NaOH溶液的物质的量浓度,可用物质的量浓度为0.1000mol•L-1HCl标准溶液进行中和滴定(用酚酞作指示剂).请回答下列问题:
欲测定某NaOH溶液的物质的量浓度,可用物质的量浓度为0.1000mol•L-1HCl标准溶液进行中和滴定(用酚酞作指示剂).请回答下列问题:| 实验序号 | 待测NaOH溶液的体积/mL | HCl标准溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 0.00 | 20.10 |
| 2 | 25.00 | 1.50 | 21.40 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
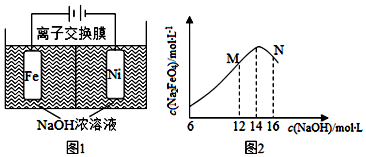
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钙元素 | B. | 碘元素 | C. | 铁元素 | D. | 钠元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
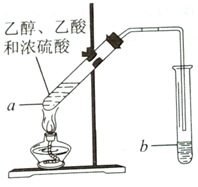 红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了香味的酯.在实验室可以用如图所示的装置制取乙酸乙酯,请回答下列问题.
红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了香味的酯.在实验室可以用如图所示的装置制取乙酸乙酯,请回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定 次数 | 盐酸体积 (mL) | NaOH溶液体积读数(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.00 | 18.10 |
| 2 | 20.00 | 0.00 | 16.30 |
| 3 | 20.00 | 0.00 | 16.22 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
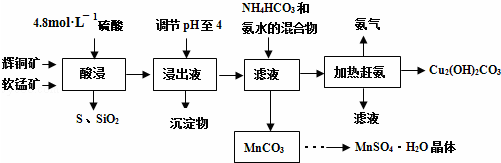
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com