
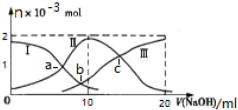
 常温下,向10mL某浓度的H2SO3溶液中滴加0.2mol•L-1 NaOH溶液,含S微粒的物质的量变化曲线如图所示,下列有关说法正确的是( )
常温下,向10mL某浓度的H2SO3溶液中滴加0.2mol•L-1 NaOH溶液,含S微粒的物质的量变化曲线如图所示,下列有关说法正确的是( )| A. | 曲线Ⅱ代表H2SO3的浓度 | |
| B. | V(NaOH)=10ml时,溶液温度最高,c(H2SO3)=0.1mol•L-1 | |
| C. | 水的电离程度大小:a点<b点<c点 | |
| D. | 若c点pH=6,则K2(H2SO3)=10-8 |
分析 向10mL某浓度的H2SO3溶液中滴加0.2mol•L-1 NaOH溶液,滴加前,溶液中H2SO3的浓度最大,随着NaOH的加入,H2SO3的浓度减小,c(HSO3-)增大,则I代表H2SO3的浓度,II代表HSO3-的浓度,当NaOH的体积为10mL时,c(HSO3-)达到最大值,继续滴加NaOH,c(HSO3-)减小,c(SO32-)增大,所以III代表SO32-的浓度;
A.由以上分析判断;
B.二者恰好完全反应时温度最高;
C.溶液中酸电离的氢离子越小,水的电离程度越大;
D.c点,c(SO32-)=c(HSO3-),根据Ka2=$\frac{c({H}^{+})×c(S{{O}_{3}}^{2-})}{c(HS{{O}_{3}}^{-})}$计算.
解答 解:向10mL某浓度的H2SO3溶液中滴加0.2mol•L-1 NaOH溶液,滴加前,溶液中H2SO3的浓度最大,随着NaOH的加入,H2SO3的浓度减小,c(HSO3-)增大,则I代表H2SO3的浓度,II代表HSO3-的浓度,当NaOH的体积为10mL时,c(HSO3-)达到最大值,继续滴加NaOH,c(HSO3-)减小,c(SO32-)增大,所以III代表SO32-的浓度;
A.由以上分析可知,I代表H2SO3的浓度,故A错误;
B.10mL某浓度的H2SO3溶液中滴加0.2mol•L-1 NaOH溶液,当NaOH的体积为20mL时,溶液中c(SO32-)增大,则此时二者接近完全反应温度最高,c(H2SO3)=0.2mol•L-1,故B错误;
C.随着NaOH的加入,溶液中酸电离的氢离子逐渐减少,水的电离程度逐渐增大,所以水的电离程度大小:a点<b点<c点,故C正确;
D.c点pH=6,则溶液中c(H+)=10-6mol/L,已知c(SO32-)=c(HSO3-),则Ka2=$\frac{c({H}^{+})×c(S{{O}_{3}}^{2-})}{c(HS{{O}_{3}}^{-})}$=10-6,故D错误.
故选C.
点评 本题考查离子反应,明确图象中酸碱混合时溶液中的溶质是解答本题的关键,抓住图中分析即可,不需要进行计算,题目难度中等,侧重于考查学生的分析能力.


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 第15列某元素能形成碱性气体 | |
| B. | 第2列元素中肯定没有非金属元素 | |
| C. | 第17列的第一种元素的原子序数为8 | |
| D. | 短周期中能与强碱反应产生H2的金属元素位于第ⅢA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{a}{A}$(m+N)mol | B. | $\frac{a}{A+2m}$ (A-N+m)mol | C. | $\frac{a}{A+m}$(A-N+m)mol | D. | $\frac{a}{A+2m}$(m+N)mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
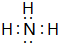 ;
;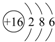 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢化物受热易分解 | |
| B. | 该元素是植物生长所需要的一种营养元素 | |
| C. | 其单质既有氧化性又有还原性 | |
| D. | 最高价氧化物对应的水化物是一种强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 铂是非金属元素,在常温下呈固态 | B. | “78”是铂的原子序数 | ||
| C. | “195.1”是铂的质量数 | D. | 铂的名称为Pt |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可用浓硝酸洗去银镜 | |
| B. | 向2%的稀氨水中滴入2%的硝酸银溶液,配得银氨溶液 | |
| C. | 采用水浴加热,也可以直接加热 | |
| D. | 试管先用热NaCl溶液洗涤,然后用蒸馏水洗涤 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
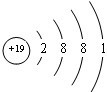 .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com