
 已知X、Y、Z、R、Q为周期表中原子序数依次增大的前36号元素.相关信息如下:
已知X、Y、Z、R、Q为周期表中原子序数依次增大的前36号元素.相关信息如下:| X元素是宇宙中最丰富的元素 |
| Y元素基态原子的核外p电子数比s电子数少1 |
| Z元素被誉为“太空金属”,也有“生物金属”之称,其基态原子次外层有2个未成对电子 |
| R元素在元素周期表的第十一列 |
| Q元素在周期表里与R元素在同一个分区 |
 .
.分析 已知X、Y、Z、R、Q为周期表中原子序数依次增大的前36号元素,X元素是宇宙中最丰富的元素,则X为H元素;Y元素原子的核外p轨道电子数比s轨道电子数少1,原子核外电子排布为1s22s22p3,则Y为N元素;Z元素被誉为“太空金属”,也有“生物金属”之称,其基态原子次外层有2个未成对电子,则Z为Ti元素;R元素在元素周期表的第十一列,属于第IB族,在第四周期,所以R为Cu;Q元素在周期表里与R元素在同一个分区,则Q为Zn元素.
(1)NH3中N原子形成3个键,含有1对孤电子对,杂化轨道数目为4;NH5属于离子化合物,由铵根离子与氢负离子构成,所有原子的最外层都符合相应稀有气体原子的最外层电子结构;
(2)CO与N2属于等电子体,二者结构相似,故CO的结构式为C≡O;
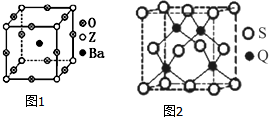
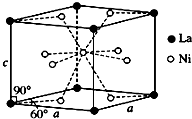
(3)①根据均摊法,可知晶胞中Ba原子数目为1,O原子数目为3、Ti原子数目为1,故A为BaTiO3,反应还②顶点Z原子与棱中心的氧原子相邻;
③在A晶体中,若将Z4+置于立方体的体心,Ba2+置于立方体的顶点,则O2-处于立方体的面心;
(4)R为Cu,其原子核外电子排布式为1s22s22p63s23p63d104s1,失去4s、3d能级个1个电子形成Cu2+;离子电荷相同,离子晶体中离子半径越小,晶体的熔点越高;
(5)根据均摊法计算晶胞中Zn、S原子数目,结合阿伏伽德罗常数表示出晶胞质量,再根据ρ=$\frac{m}{V}$计算.
解答 解:已知X、Y、Z、R、Q为周期表中原子序数依次增大的前36号元素,X元素是宇宙中最丰富的元素,则X为H元素;Y元素原子的核外p轨道电子数比s轨道电子数少1,原子核外电子排布为1s22s22p3,则Y为N元素;Z元素被誉为“太空金属”,也有“生物金属”之称,其基态原子次外层有2个未成对电子,则Z为Ti元素;R元素在元素周期表的第十一列,属于第IB族,在第四周期,所以R为Cu;Q元素在周期表里与R元素在同一个分区,则Q为Zn元素.
(1)NH3中N原子形成3个键,含有1对孤电子对,杂化轨道数目为4,N原子杂化类型为sp3,NH5属于离子化合物,由铵根离子与氢负离子构成,电子式为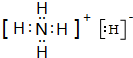 ;
;
故答案为:sp3;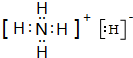 ;
;
(2)CO与N2互为等电子体,二者结构相似,所以CO分子结构式为C≡O,则1 个CO分子中含有的π键数目是2,
故答案为:2;
(3)①可知晶胞中Ba原子数目为1,O原子数目为12×$\frac{1}{4}$=3、Ti原子数目为8×$\frac{1}{8}$=,故A为BaTiO3,反应还生成二氧化碳,反应方程式为:TiO2+BaCO3═BaTiO3+CO2↑,
故答案为:TiO2+BaCO3═BaTiO3+CO2↑;
②由BaTiO3晶胞可知,每个Ti4+周围有6个O2-,所以Ti4+的氧配位数为为6,
故答案为:6;
③在BaTiO3晶体中,若将Ti4+置于立方体的体心,Ba2+置于立方体的顶点,则O2-只能处于立方体的面心,
故答案为:面心;
(4)R为Cu,其原子核外电子排布式为1s22s22p63s23p63d104s1,则Cu2+离子的外围电子层电子排布式为3d9;离子电荷相同,氧离子半径小于硫离子半径,所以Cu2O的熔点比Cu2S的高;
故答案为:3d9;高;
(5)晶胞中S原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,Zn原子位于晶胞内部,共4个,则晶胞质量为4×(65+32)g/mol÷6.02×1023mol-1),晶胞的体积为(540.0×10-10cm)3,则密度为ρ=$\frac{4×\frac{(65+32)g/mol}{6.02×1{0}^{23}mo{l}^{-1}}}{(540×1{0}^{-10}cm)^{3}}$=4.1g•cm-3;
故答案为:$\frac{4×\frac{(65+32)g/mol}{6.02×1{0}^{23}mo{l}^{-1}}}{(540×1{0}^{-10}cm)^{3}}$=4.1.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、杂化类型、等电子体、晶体类型与性质、晶胞计算等,掌握均摊法进行晶胞有关计算.


科目:高中化学 来源: 题型:选择题
| A. | K2S | B. | SO2 | C. | H2S | D. | SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Z的氢化物的沸点是同主族元素中最高的 | |
| B. | 由X、Y、Z三种元素中的任意两种组成的具有10电子的微粒只有2种 | |
| C. | 仅由X、Y两种元素组成的化合物不止一种 | |
| D. | X和Z可以组成原子个数比分别为1:1和2:1常温下为液态的两种化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 钛、铬、铁、镍、铜等金属及其化合物在工业上有重要用途.
钛、铬、铁、镍、铜等金属及其化合物在工业上有重要用途.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 铜、镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料.请回答:
铜、镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 ,丙的电子式为
,丙的电子式为 ,E在周期表中的位置为第三周期VA族.
,E在周期表中的位置为第三周期VA族.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 已知 N2(g)+3H2 (g)═2NH3(g)△H=-92.4 kJ•mol-1,当有 1molNH3时,上述反应的△H 变为-46.2 kJ•mol-1 | |
| B. | 1mol 羟基(-OH)与 17gNH3所含电子数都为NA | |
| C. | 由 8.0gCH3COONa 和少量 CH3COOH 形成的中性溶液中,CH3COO-数目为0.1NA | |
| D. | 常温常压下,7.1gCl2与足量的Fe粉反应转移的电子数为0.2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com