
| A. | 键能:F-F>Cl-Cl>Br-Br>I-I | |
| B. | 键长:F-F<Cl-Cl<Br-Br<I-I | |
| C. | 苯、CO2是非极性分子,甲醛是极性分子 | |
| D. | 苯和B3N3H6互为等电子体 |
分析 A.气态基态原子形成1mol化学键释放的最低能量就是该共价键的键能,键能与成键原子间的核间距、以及同种电荷排斥力有关;
B.同周期从上往下,半径逐渐增大,原子半径越大,共价键键长越大;
C.极性分子中正负电荷的中心不重合,具有一定的极性,极性分子是由极性键构成的结构不对称的分子;
D.价电子总数相等,原子数也相等互为等电子体.
解答 解:A.F-F的键长短原子核距离近,同种电荷排斥力强,势能大使内能也较大,Cl-Cl键,原子核距离远,同种电荷排斥力小,势能小使内能也较小,所以键能:F-F<Cl-Cl,故A错误;
B.F、Cl、Br、I属于同一主族,从上到下原子半径增大,则原子半径:F<Cl<Br<I,原子半径越大,共价键键长越大,则共价键的键长:F-F<Cl-Cl<Br-Br<I-I,故B正确;
C.二氧化碳,平面直线型结构,空间结构对称,正负电荷的中心重合,属于非极性分子,苯为平面正六边形,空间结构对称是非极性分子,甲醛分子的空间结构不对称属于极性分子,故C正确;
D.苯与B3N3H6价电子总数相等,原子数也相等互为等电子体,故D正确;
故选A.
点评 本题考查微粒性质的比较,涉及键能、键长的比较、极性分子的判断、等电子体等,涉及知识点较多,注重高频考点的考查,注意归纳规律性知识,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:推断题
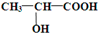
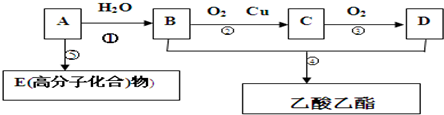
 CH3COOC2H5+H2O
CH3COOC2H5+H2O查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24L苯中含有碳碳双键的数目为0.3NA | |
| B. | 标准状况下,22.4LC12与某物质充分反应,一定转移NA个电子 | |
| C. | 1L0.1mol•L-1的HF溶液中含有的分子数一定大于0.1NA | |
| D. | 含有10.7gFe(OH)3的氢氧化铁胶体中胶粒总数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
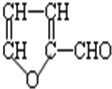 木糖的分子式为C5H10O5,属于多羟基醛,木糖在浓硫酸作用下生成糠醛(结构简式如图).
木糖的分子式为C5H10O5,属于多羟基醛,木糖在浓硫酸作用下生成糠醛(结构简式如图).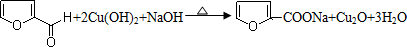 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①④ | C. | ②③ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 消耗amolA物质的同时消耗amolC物质 | |
| B. | 混合气体的质量不再改变 | |
| C. | B物质的浓度不再改变 | |
| D. | 容器内的压强不再改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
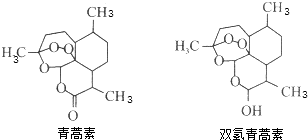
| A. | 青蒿素的分子式为C15H20O5 | |
| B. | 1 mol青蒿素最多能和1 molBr2发生加成反应 | |
| C. | 双氢青蒿素能发生氧化反应、酯化反应 | |
| D. | 青蒿素转化为双氢青蒿素发生了氧化反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com