
【题目】研究大气中含硫化合物(主要是SO2和H2S)的转化对环境保护具有重要意义。
(1)SO2的大量排放会引起严重的环境问题是 ,潮湿条件下,写出大气中SO2转化为HSO3-的方程式
(2)土壤中的微生物可将大气中H2S经两步反应氧化成SO42-,两步反应的能量变化示意图如下:
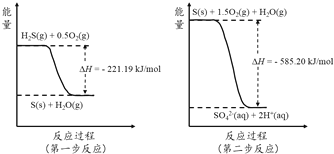
1mol H2S(g)全部氧化成SO42-(aq)的热化学方程式为
(3)SO2时工业制硫酸的原料之一,一定温度下,向容积为2L的密闭容器中充入一定量的SO2和O2,发生反应:2SO2(g)+O2(g) ![]() 2SO3(g),过程中测定的部分数据见下表:
2SO3(g),过程中测定的部分数据见下表:
时间/min | n(SO2)/mol | n(O2)/mol |
0 | 0.10 | 0.050 |
4 | 0.050 | 0.025 |
5 | 0.040 | |
8 | 0.020 |
①反应在0-4min内的平均速率为v(SO2)= ;
②此温度下该反应的化学平衡常数K= 。
③8min时,维持温度不变,往反应容器中再通入0.020molSO2(g),0.010molO2(g),重新达到平衡时混合气体中SO2的百分含量将 (填“减小”、“增大”或“不变”。)
(4)将H2S和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应回收S,其物质转化入右图所示:
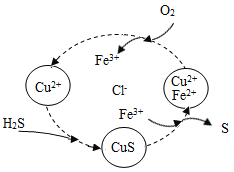
①在温度一定和不补加溶液的条件下,缓慢通入混合气体,并充分搅拌。欲使生成的硫单质中不含CuS,可采取的措施有 。
②一般来说,如果一个反应的平衡常数大于105,通常认为反应进行得较安全;相反,如果一个反应的平衡常数夏普与10-5,则认为这个反应很难进行。
已知常温下各物质的溶度积及电离平衡常数:
CuS:Ksp=6.3×10-36;H2S:Ka1=1.3×10-7,Ka2=7.1×10-15,
通过计算说明反应CuS(s)+2H+(aq)=Cu2+(aq)+H2S(aq)进行的程度
【答案】
(1)酸雨;SO2+H2O![]() HSO3-+H+;
HSO3-+H+;
(2)H2S(g)+2O2(g)=SO42-(aq)+2H+(aq) ΔH=-806.39KJ/mol ;
(3)①6.25×10-3mol/(L·min);②225(mol/L)-1;③减小;
(4)通入足量的空气(或氧气);K=Ksp(CuS)/Ka1·Ka2=6.83×10-15<10-5,反应很难进行;
【解析】
试题分析:(1)SO2的大量排放会导致酸雨,潮湿条件下,写出大气中SO2转化为HSO3-的方程式为SO2+H2O![]() HSO3-+H+,故答案为:酸雨;SO2+H2O
HSO3-+H+,故答案为:酸雨;SO2+H2O![]() HSO3-+H+;
HSO3-+H+;
(2)由图可知,第一步热化学反应为:H2S(g)+0.5O2(g)=S(s)+H2O(g)△H=-221.19 kJmol-1;第二步反应为:S(s)+1.5O2(g)+H2O(g)=2H+(aq)+SO42-(aq))△H=-585.20 kJmol-1;依据盖斯定律,第一步与第二步方程式相加得:H2S(g)+2O2(g)=SO42-(aq)+2H+(aq)△H=-806.39 kJmol-1;故答案为:H2S(g)+2O2(g)=SO42-(aq)+2H+(aq)△H=-806.39 kJmol-1;
(3)①反应在0-4min内的平均速率为v(SO2)=![]() =
= =6.25×10-3mol/(L·min),故答案为:6.25×10-3mol/(L·min);
=6.25×10-3mol/(L·min),故答案为:6.25×10-3mol/(L·min);
②此温度下,5min时反应的二氧化硫的物质的量为0.06mol,则反应的氧气的物质的量为0.03mol,剩余氧气0.02mol,则5min是反应已经达到平衡状态,平衡时c(SO2)=0.02mol/L,c(O2)= 0.01mol/L,c(SO3) = 0.03mol/L,反应的化学平衡常数K=![]() =225,故答案为:225;
=225,故答案为:225;
③8min时,维持温度不变,往反应容器中再通入0.020molSO2(g),0.010molO2(g),相当于增大压强,平衡正向移动,重新达到平衡时混合气体中SO2的百分含量将减小,故答案为:减小;
(4)①使生成的硫单质中不含CuS,则硫离子不能有剩余,硫离子完全被氧化为硫单质,所以氧气必须过量,采取的措施是:通入足量的空气(或氧气或增大混合气体中空气的比例),故答案为:通入足量的空气(或氧气或增大混合气体中空气的比例);
②Ksp=c(Cu2+)c(S2-);H2S:Ka1=![]() ;Ka2=
;Ka2=![]() ,CS(s)+2H+Cu2++H2S,反应的K=
,CS(s)+2H+Cu2++H2S,反应的K=![]() =Ksp÷Ka2÷Ka1=8.4×10-36mol2L-2÷1.2×10-7molL-1÷7×10-15molL-1=1×10-14<10-5,所以反应难以进行;故答案为:此反应K﹦1×10-14<10-5,所以反应难以进行。
=Ksp÷Ka2÷Ka1=8.4×10-36mol2L-2÷1.2×10-7molL-1÷7×10-15molL-1=1×10-14<10-5,所以反应难以进行;故答案为:此反应K﹦1×10-14<10-5,所以反应难以进行。


 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案科目:高中化学 来源: 题型:
【题目】下图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物。

已知:①反应![]() 能放出大量的热,该反应曾应用于铁轨的焊接;
能放出大量的热,该反应曾应用于铁轨的焊接;
②I是一种常见的温室气体,它和![]() 可以发生反应:2E+I 2F+D,F中的E元素的质量分数为60%.回答问题:
可以发生反应:2E+I 2F+D,F中的E元素的质量分数为60%.回答问题:
(1)①中反应的化学方程式为_____________________;
(2)化合物Ⅰ的电子式为________________,它的空间构型是_________;
(3)1.6g G 溶于盐酸,得到的溶液与铜粉完全反应,至少所需铜粉的质量为 g;
(4)C与过量NaOH溶液反应的离子方程式为_____________,反应后溶液与过量化合物Ⅰ反应的离子方程式:__________________;
(5)实验室中一般检验I存在的试剂和方法是:___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在烷烃分子中的基团:CH3、CH2、![]() 、
、![]() 中的碳原子,分别称为伯、仲、叔、季碳原子,数目分别用nl、n2、n3、n4表示。
中的碳原子,分别称为伯、仲、叔、季碳原子,数目分别用nl、n2、n3、n4表示。
例如: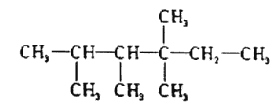 分子中,nl=6,n2=1,n3=2,n4=1。在烷烃(除甲烷外)分子中,各种类型的原子个数之间存在着一定的关系。试根据不同烷烃的组成和结构,分析出烷烃(除甲烷外)中各原子数的关系。
分子中,nl=6,n2=1,n3=2,n4=1。在烷烃(除甲烷外)分子中,各种类型的原子个数之间存在着一定的关系。试根据不同烷烃的组成和结构,分析出烷烃(除甲烷外)中各原子数的关系。
(1)烷烃分子中氢原子数为A,A与nl、n2、n3、n4的关系是:A=_________,或A=_________。
(2)四种碳原子数之间的关系为nl=____________。
(3)若某分子中n2=n3=n4=1,写出该分子的结构简式和键线式,并对其进行命名:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活、生产联系密切,下列说法不正确的是( )
A.生石灰、铁粉常用于食品干燥剂
B.“地沟油”经过加工处理后可用来制肥皂
C.抗酸药如小苏打可治疗因胃酸过多引起的消化不良
D.以粮食为原料酿酒过程的变化包括粮食→淀粉→葡萄糖→乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃、101 kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5 kJ/mol、285.8 kJ/mol、890.3kJ/mol、2800 kJ/mol。则下列热化学方程式正确的是( )
A.C(s)+![]() O2(g)===CO(g) ΔH=-393.5 kJ/mol
O2(g)===CO(g) ΔH=-393.5 kJ/mol
B.2H2(g)+O2(g)===2H2O(l) ΔH=+571.6 kJ/mol
C.CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3 kJ/mol
D.![]() C6H12O6(s)+3O2(g)===3CO2(g)+3H2O(l) ΔH=-1400 kJ/mol
C6H12O6(s)+3O2(g)===3CO2(g)+3H2O(l) ΔH=-1400 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,纯水中由水电离的c(H+)=a mol·L-1,pH=1的盐酸中由水电离的c(H+)=b mol·L-1,。0.1 mol·L-1的盐酸与0.1 mol·L-1的氨水等体积混合后,由水电离的c(H+)=c mol·L-1,则a、b、c的关系正确的是( )
A.a>b=c B.c>a>b
C.c>b>a D.b>c>a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4、H2、C都是优质的能源物质,它们燃烧的热化学方程式为:
①CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1
②2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
③C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1
(1)在深海中存在一种甲烷细菌,它们依靠酶使甲烷与O2作用产生的能量存活,甲烷细菌使1 mol甲烷生成CO2气体与液态水,放出的能量________(填“>”“<”或“=”)890.3 kJ。
(2)甲烷与CO2可用于合成合成气(主要成分是一氧化碳和氢气):CH4+CO2===2CO+2H2,1 g CH4完全反应可释放15.46 kJ的热量,则:
①能表示该反应过程中能量变化的是________(填字母)。
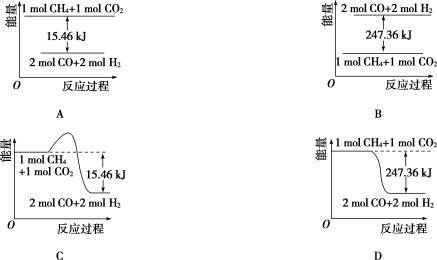
②若将物质的量均为1 mol的CH4与CO2充入某恒容密闭容器中,体系放出的热量随着时间的变化如图所示,则CH4的转化率为_________________。
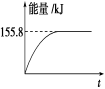
(3)C(s)与H2(g)不反应,所以C(s)+2H2(g)===CH4(g)的反应热无法直接测量,但通过上述反应可求出C(s)+2H2(g)===CH4(g)的反应热ΔH=______________。
(4)目前对于上述三种物质的研究是燃料研究的重点,下列关于上述三种物质的研究方向中可行的是______________(填字母)。
A.寻找优质催化剂,使CO2与H2O反应生成CH4与O2,并放出热量
B.寻找优质催化剂,在常温常压下使CO2分解生成碳与O2
C.寻找优质催化剂,利用太阳能使大气中的CO2与海底开采的CH4合成合成气(CO、H2)
D.将固态碳合成为C60,以C60作为燃料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在温度T1和T2时,分别将0.50 mol CH4和1.20 mol NO2充入体积为1 L的密闭容器中,发生如下反应:CH4(g)+2NO2(g) ![]() N2(g)+CO2(g)+2H2O(g),测得n(CH4)随时间变化数据如下表:
N2(g)+CO2(g)+2H2O(g),测得n(CH4)随时间变化数据如下表:
时间/min | 0 | 10 | 20 | 40 | 50 | |
T1 | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
T2 | n(CH4)/mol | 0.50 | 0.30 | 0.18 | …… | 0.15 |
下列说法正确的是( )
A.该反应的ΔH>0、T1<T2
B.T2时CH4的平衡转化率为30.0%
C.T2时40min后,断裂4mol C-H键同时断裂4 mol O-H键
D.T1时向平衡体系中再充入CH4,建立平衡后CO2的体积分数一定增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关氧化还原反应的叙述中,正确的是( )
A. 一定有氧元素参加 B. 氧化剂本身发生氧化反应
C. 氧化反应一定先于还原反应发生 D. 一定有电子转移(得失或偏移)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com