下列说法正确的是(NA表示阿伏加德罗常数)( )
A.标准状况下,以任意比例混合的甲烷和丙烷(C3H8)的气体混合物11.2L,则所含有的分子数为NA
B.标准状况下,1molCl2在反应中一定得到2NA电子
C.常温常压下,活泼金属从盐酸中置换出1molH2时发生转移的电子数为2NA
D.常温常压下,1mol氦气含有的核外电子数为4NA
【答案】
分析:A.根据n=
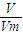
计算;
B.氯气在反应中可作氧化剂也可作还原剂,转移电子数目在不同的情况下不一样;
C.盐酸中的氢元素为+1价,氢气中的氢元素为0价;
D.1个氦原子核外有2个电子;
解答:解:A.标准状况下,气体摩尔体积22.4L/mol,根据n=
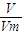
=

=0.5mol,则所含有的分子数为0.5N
A,故A错误;
B.氯气只作氧化剂时,1 mol Cl
2发生反应,转移的电子为2mol,但在发生歧化反应时,情况就有所不同,氯气与氢氧化钠反应:Cl
2+2NaOH=NaCl+NaClO+H
2O,1mol氯气完全反应,氯从0价的单质氯变成+1价的NaClO中的氯,失去1mol电子,氯从0价的单质氯变成-1价的NaCl中的氯,得到1mol电子,故B错误;
C.金属与盐酸反应,金属失去电子,盐酸中+1的氢元素得到电子变为产物中0价的氢,每生成1molH
2,金属失去2mol电子,氢得到2mol电子,所以,常温常压下,活泼金属从盐酸中置换出1molH
2时发生转移的电子数为2N
A,故C正确;
D.1个氦原子核外有2个电子,常温常压下,1mol氦气含有的核外电子数为2N
A,故D错误;
故选C.
点评:本题考查了阿伏伽德罗常数的有关问题,注意物质与微粒的关系,注意单位的运用,题目较简单.

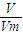 计算;
计算;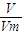 =
= =0.5mol,则所含有的分子数为0.5NA,故A错误;
=0.5mol,则所含有的分子数为0.5NA,故A错误;
