
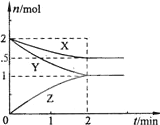
 �������̶���2L�ܱ������У�һ�������£��������·�ӦX��g��+2Y��g��?n Z��g������Ӧ�����и����ʵ����ʵ�����ʱ��Ĺ�ϵ��ͼ��ʾ���������й���������ȷ���ǣ�������
�������̶���2L�ܱ������У�һ�������£��������·�ӦX��g��+2Y��g��?n Z��g������Ӧ�����и����ʵ����ʵ�����ʱ��Ĺ�ϵ��ͼ��ʾ���������й���������ȷ���ǣ�������| A���ڢۢݢ� | B���ڢܢ� |
| C���ڢۢܢ� | D���٢ۢܢ� |
| n(��Ӧ) |
| n(��ʼ) |
| n(��Ӧ) |
| n(��ʼ) |
| 2mol-1mol |
| 2mol |
| ||
| t |
| ||
| 2min |
| 1.5mol |
| 2L |
| P(ƽ��) |
| P(��ʼ) |
| n(ƽ��) |
| n(��ʼ) |
| 3.5 |
| 4 |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
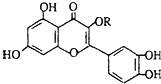 ��Ȼά����P���ṹ��ͼ�������ڻ��������У�����һ��Ӫ��������������ά����P ������������ǣ�������
��Ȼά����P���ṹ��ͼ�������ڻ��������У�����һ��Ӫ��������������ά����P ������������ǣ�������| A�����Ժ���ˮ��Ӧ |
| B�������л��ܼ���ȡ |
| C��������������� |
| D��1molά����P���Ժ�3molNaOH��Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�������Ӳ֬�� |
| B�������Ӳ֬�� |
| C������Ͷ��� |
| D������ͱ�ϩ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A���κ������£���ˮ��pH����7 |
| B��95�洿ˮ��c��H+����10-7 mol?L-1 |
| C��95�洿ˮ��pH����7 |
| D���κ������£���ˮ�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����ȼ |
| B������ͨ��������Ȼ�̼��Һ |
| C������ͨ�����Ը��������Һ |
| D������ͨ������������Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A��2KClO3
| ||||
| B��NH3+HCl=NH4Cl | ||||
C��MnO2+4HCl��Ũ��
| ||||
| D��Ba��OH��2+MgSO4=BaSO4��+Mg��OH��2�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�������ƶ� | B�������ƶ� |
| C�����ƶ� | D�����ж� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 CO��g����H2O��g����Ӧ����CO2��g����H2��g�����̵������仯��ͼ��ʾ���й����߷�Ӧ��˵����ȷ���ǣ�������
CO��g����H2O��g����Ӧ����CO2��g����H2��g�����̵������仯��ͼ��ʾ���й����߷�Ӧ��˵����ȷ���ǣ�������| A��CO��g����H2O��g�������е�������С��CO2��g����H2��g�������е������� |
| B��1mol CO2��g����1mol H2��g����Ӧ����1molCO��g����1molH2O��g��Ҫ�ų�41kJ���� |
| C����Ӧ���Ȼ�ѧ����ʽ�ǣ�CO��g��+H2O��g��=CO2��g��+H2��g����H=+41kJ/mol |
| D���÷�ӦΪ���ȷ�Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��Ag+��K+��NO3-��S2- |
| B��Fe3+��NH4+��SO42-��NO3- |
| C��Fe2+��Na+��Cl-��ClO- |
| D��H+��Cl-��SO42-��AlO2- |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com