
| A. | 过滤 | B. | 蒸馏 | C. | 结晶 | D. | 萃取 |
 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 油脂有油和脂肪之分,在分类上都属于酯类 | |
| B. | 油脂、蛋白质都是由C、H、O三种元素组成 | |
| C. | 糖类、油脂、蛋白质都是高分子化合物 | |
| D. | 糖类、油脂、蛋白质都能发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
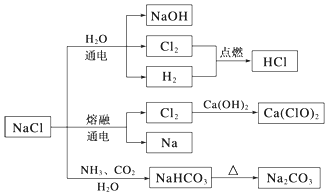
| A. | 由氯化钠制备纯碱的过程中,利用了物质溶解度的差异 | |
| B. | 用Cl2制备漂白粉时,是将Cl2通入澄清石灰水中 | |
| C. | 常温下干燥的Cl2能用钢瓶贮存,所以Cl2不与铁反应 | |
| D. | 图示转化反应都是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
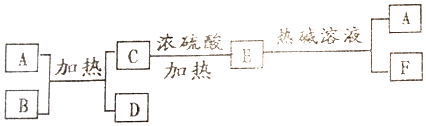
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2CO(g)═2C(s)+O2(g) | B. | NH4Cl(s)=NH3(g)+HCl(g) | ||
| C. | (NH4)2CO3(s)═NH4HCO3(s)+NH3(g) | D. | MgCO3(s)═MgO(s)+CO2(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验序号 | 温度(℃) | 初始CCl4浓度(mol•L-1) | 初始H2浓度(mol•L-1) | CCl4的平衡转化率 |
| 1 | 110 | 1 | 1 | 50% |
| 2 | 100 | 1 | 1 | X |
| 3 | 110 | 0.8 | Y | 60% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com