
【题目】氢氧燃料电池是符合绿色化学理念的新型发电装置。如图为该电池的工作原理示意图,该电池的电极表面镀一层细小的铂粉,吸附气体的能力强,性质稳定。请回答:
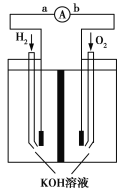
(1)氢氧燃料电池放电时能量转化形式主要是__________,在导线中电子流动方向为________(用a.b表示)。
(2)负极反应式为__________________。
(3)电极表面镀铂粉的原因为__________________。
(4)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一,金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
Ⅰ.Li+H2![]() 2LiH
2LiH
Ⅱ.LiH+H2O===LiOH+H2↑
①反应Ⅰ中的还原剂是________,反应Ⅱ中的氧化剂是____________。
②知LiH固体的密度为0.82 g/cm3。用锂吸收224 L(标准状况)H2,生成的LiH体积与被吸收的H2体积比为________。
③将由②生成的LiH与H2O作用放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为________mol。
【答案】(14分,除标明外,每空2分)
(1)由化学能转变为电能 由a到b(表达形式合理均可)
(2)2H2+4OH--4e-===4H2O或H2+2OH--2e-===2H2O
(3)增大电极单位面积吸附H2、O2的分子数,加快电极反应速率
(4)①Li(1分) H2O(1分) ②8.71×10-4∶1 ③32
【解析】(1)原电池是把化学能转化成电能的装置。电池总反应式为2H2+O2===2H2O,其中H元素从0价升至+1价,失去电子,即电子在导线中从a流向b。(2)负极为失去电子的一极,即H2失电子生成H+,由于溶液是呈碱性的,故负极反应式为H2+2OH--2e-===2H2O。(3)电极表面镀铂粉可增大电极单位面积吸附H2、O2的分子数,可以加快反应速率。(4)①反应Ⅰ中Li元素从0价升至+1价,故Li作还原剂。反应Ⅱ中H2O中的H元素从+1价降至H2中的0价,故H2O作氧化剂。②由反应I可知,当锂吸收10 mol H2时,则生成20 mol LiH,V(LiH)=![]() ×10-3 L=1.951×10-1 L,则
×10-3 L=1.951×10-1 L,则![]() =
=![]() =8.71×10-4。③20 mol LiH可生成20 mol H2则实际参加反应的H2为20 mol×80%=16 mol,因1 mol H2转化成1 mol H2O的过程中转移2 mol电子,所以16 mol H2在反应中可转移32 mol电子。
=8.71×10-4。③20 mol LiH可生成20 mol H2则实际参加反应的H2为20 mol×80%=16 mol,因1 mol H2转化成1 mol H2O的过程中转移2 mol电子,所以16 mol H2在反应中可转移32 mol电子。


科目:高中化学 来源: 题型:
【题目】下列各组离子在水溶液中能够大量共存的是
A. OH -、 K+、NH4+ B. Ba2+、 SO42 -、H+
C. Ag+、 K+、Cl - D. Na+、 Cl -、 CO32 -
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】填空题
(1)I.比较原子半径的大小:OF;(填“>”或“<”,下同)
(2)比较酸性强弱:H3PO4H2SiO3
(3)稳定性:NH3PH3
(4)II.写出下列物质形成过程的电子式: HCl
(5)MgCl2 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应中的能量变化是人类获取能量的重要途径.
(1)液化气是一种重要的家用燃料,下列示意图与液化气在燃烧过程中的能量变化最相符的是(填字母). 
(2)“冰袋”可用于短时间保鲜食物.将一定量的碳酸钠晶体与硝酸铵晶体密封于一塑料袋中,用线绳绑住塑料袋中间部分,使两种晶体隔开,做成“冰袋”.使用时将线绳解下,用手将袋内两种固体粉末充分混合,便立即产生低温.由此判断:反应后生成产物的总能量(填“高于”或“低于”)碳酸钠晶体与硝酸铵晶体的总能量.
(3)化学反应中的能量变化不仅仅表现为热量的变化,有时还可以表现为其他形式的能量变化.比如,蜡烛燃烧可用来照明,这个过程是将化学能转化为光能和;人们普遍使用的干电池工作时是将化学能转化为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜和镁的合金4.6g完全溶于浓硝酸,若反应中硝酸被还原只产生4480mL的NO2气体和336mL的N2O4气体(都已折算到标准状况),在反应后的溶液中,加入足量的氢氧化钠溶液,生成沉淀的质量为( )
A.9.02 g
B.8.51 g
C.8.26 g
D.7.04 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,我国拥有完全自主产权的氢氧燃料电池车将在北京奥运会期间为运动员提供服务。某种氢氧燃料电池的电解质溶液为KOH溶液。下列有关该电池的叙述不正确的是
A. 正极反应式为:O2+2H2O+4e-=4OH-
B. 工作一段时间后,电解质溶液中KOH的物质的量不变
C. 该燃料电池的总反应方程式为:2H2+O2=2H2O
D. 用该电池电解CuCl2溶液,产生2.24 L Cl2(标准状况)时,有0.1 mol电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一个绝热恒容密闭容器中通入CO(g)和H2O(g),一定条件下使反应CO(g)+H2O(g)![]() CO2(g)+H2(g)达到平衡,正反应速率随时间变化的曲线如图所示,由图可得出的结论错误的是( )
CO2(g)+H2(g)达到平衡,正反应速率随时间变化的曲线如图所示,由图可得出的结论错误的是( )

A. 反应物浓度:a点大于c点
B. c点反应进行的程度最大
C. 该反应的正反应为放热反应
D. Δt1=Δt2时,H2的产率:a~b段小于b~c段
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体氧化物燃料电池是由美国西屋(Westinghouse)公司研制开发的。它以固体氧化锆-氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过。该电池的工作原理如下图所示,其中多孔电极a、b均不参与电极反应。下列判断正确的是( )

A. 有O2放电的a极为电池的负极
B. 有H2放电的b极为电池的负极
C. a极对应的电极反应为O2+2H2O+4e-===4OH-
D. b极对应的电极反应为2H2-4e-+4OH-===4H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com