
已知氯酸钾和亚硫酸氢钠发生氧化还原反应,生成-1价的氯和+6价的硫的化合物,反应速率(v)与时间(t)的关系如下图所示。
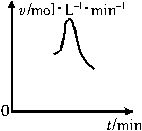
已知该反应的反应速率随溶液中氢离子浓度的增大而加快,试解释:
(1)反应开始时,反应速率加快的原因是__________________________________。
(2)反应后期,反应速率下降的原因是_____________________________________。
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:022
已知氯酸钾和亚硫酸氢钠发生氧化还原反应时,生成-1价的氯和+6价的硫的化合物,反应速v和反应时间,t的关系如图所示.

已知这个反应的反应速率随溶液中氢离子浓度增大而加快,试解释:
(1)反应开始后,反应速率加快的原因是_______________________.
(2)反应后期,反应速率下降的原因是_________________________.
查看答案和解析>>
科目:高中化学 来源:高中化学习题 题型:022
已知氯酸钾和亚硫酸氢钠溶液可发生氧化还原反应,请写出这一化学反应的离子方程式_______,伴随这个化学反应的发生,溶液的pH的变化规律是_______.
通过这实验测得这个反应的化学反应速率的变化如右图所示.
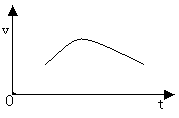
(1)在反应开始后的一段时间里,反应速率加快的原因是:______________________________________________
(2)反应后期反应速率又会逐渐下降,其原因可能是_____________________________________________
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:058
已知氯酸钾和亚硫酸氢钠发生氧化还原反应时,生成-1价的氯和+6价的硫的化合物,反应速v和反应时间,t的关系如图所示.
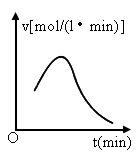
已知这个反应的反应速率随溶液中氢离子浓度增大而加快,试解释:
(1)反应开始后,反应速率加快的原因是_______________________.
(2)反应后期,反应速率下降的原因是_________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:

图2-4
(1)为什么反应开始一段时间内速率逐渐加快?
(2)为什么后期反应速率逐渐减慢?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com