
【题目】I、下列七种有机物中:
①CH4
②CH2=CH2
③![]()
④CH3COOH
⑤HOCH2CHO
⑥CH3CH2CH2CH3
⑦葡萄糖
⑧蛋白质
⑨淀粉
(1)可与浓硝酸发生颜色反应的是______________(填序号,下同)。
(2)属于同系物的是 。
(3)互为同分异构体的是___________。
(4)易发生银镜反应的是______________。
II、在5L的密闭容器中充入1mol A 和2mol B,在一定条件下发生反应4A(g)+5B(g)![]() 4C(g)+6D(g),半分钟后,C的物质的量增加了0.30mol。
4C(g)+6D(g),半分钟后,C的物质的量增加了0.30mol。
(5)D的平均反应速率为 。
(6)A的转化率为 。
(7) 不能判断该反应已达平衡状态的是 。
A .单位时间内生成n mol A的同时生成2n mol D的状态
B .生成物浓度不再变化的状态
C .混合气体的平均相对分子质量不再改变的状态
D .混合气体的压强不再改变的状态
E. 容器中各组分的体积分数不随时间变化的状态
F .容器中A、B、C、D的物质的量的比一定是4:5:4:6的状态
【答案】I、(每空1分,共4分)(1)⑧ (2)①⑥ (3)④⑤ (4)⑤⑦(只选对一个不给分);
II、(4分)(5)0.18mol·L-1·min-1 (1分,没有单位0分) (6)30% (或0.3)
(7)AF(对一个给1分,错一个给0分,共2分)。
【解析】
试题分析:(1)能与浓硝酸发生显色反应的有机物为蛋白质,答案为:⑧;(2)同系物为结构相似,组成上相差1个或若干个CH2原子团的有机物的互称,答案为①⑥;(3)同分异构体是分子式相同结构式不同的化合物,答案为④⑤;(5)易发生银镜反应的有机物需含有醛基,HOCH2CHO和葡萄糖中含有醛基,答案为⑤⑦;II、(4)v(C)=△c÷△t=(0.30mol÷5L)÷0.5min=0.12mol/(Lmin),由于化学反应速率比等于方程式中相应物质的化学计量数的比,所以v(D)=6/4 v(C)=6/4×0.12 mol/(Lmin)= 0.18 mol/(Lmin);(6)A的转化率为Ψ=(A的变化量÷A的起始量)×100%=(0.30mol÷1mol) ×100%=30%;(7)A单位时间内生成n molA的同时生成2n molD的状态,变化量之比不等物质的量之比,所以未平衡,错误;B生成物浓度不再变化的状态,说明B的物质的量不变,说明达平衡状态,正确;C混合气体的平均相对分子质量不再改变的状态,说明气体的物质的量不变,说明达平衡状态,正确;D混合气体的压强不再改变的状态,说明气体的物质的量不变,说明达平衡状态,正确;E容器中各组分的体积分数不随时间变化的状态,说明各组分的物质的量不变,说明达平衡状态,故正确;F容器中A、B、C、D的物质的量的比一定是4:5:4:6的状态,并不是不变的状态,所以不一定是平衡状态,错误;所以正确答案是AF。


科目:高中化学 来源: 题型:
【题目】某研究性学习小组对铝热反应实验展开研究。现行高中化学教材中对“铝热反应” 的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有 熔融物落人沙中”。査阅《化学手册》知,Al、Al2O3、Fe、Fe2O3的熔、沸点数据如下:
物质 | Al | Al2O3 | Fe | Fe2O3 |
熔点/℃ | 660 | 2 054 | 1535 | 1462 |
沸点/℃ | 2467 | 2980 | 2750 | — |
I.(1)某同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是:该反应放出的热量使铁熔化,而铝的熔点比铁的低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理:________(填“合理”或“不合理”)。
(2)设汁一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是________,反应的离子方程式为___________。
II.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。若铁被氧化为Fe3+,在反应结束后的溶液中,逐滴加入4mol/L的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。

回答下列问题:
(1)图中OC段没有沉淀生成,此阶段发生反应的离子方程式为____________。在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为____________。
(2)B与A的差值为_________mol。B点对应的沉淀的物质的量为___________mol,C点对应的氢氧化钠溶液的体积为____________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液X,可能含有Al3+、Ba2+、NH4+、Fe2+、Fe3+、CO32-、SiO32-、NO3-的一种或几种离子,取该溶液进行实验.其现象及转化如图。反应过程中有一种气体是红棕色。
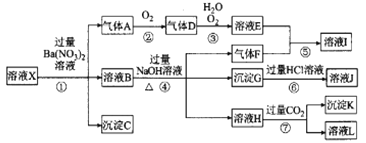
请回答下列问题:
(1)由强酸性条件即可到断溶液X中一定不存在的离子有_____________。
(2)溶液X中,关于NO3-的判断一定正确的是___________。
a.一定有 b.一定没有 c.可能有
(3)产生气体A的离子方程式为____________。
(4)转化⑥发生反应的现象为____________。
(5)转化④中产生H的离子方程式为____________。
(6)若转化③中,D、H2O、O2三种物质恰好发生化合反应生成E,则反应中D与O2的物质的量之比为_____________。
(7)对不能确定是否存在的离子,可以另取X溶液,加入下列溶液中的一种,根据现象即可判断,该试剂最好是______________。
①NaOH溶液 ②KSCN溶液 ③石蕊试剂 ④pH试纸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 共价化合物中可能含有离子键
B. Ca2+、K+、Cl﹣、S2﹣四种粒子的离子半径依次减小
C. ![]() Po、
Po、![]() Po、
Po、![]() Po三种原子的核外电子数分别为124、125、126
Po三种原子的核外电子数分别为124、125、126
D. 第ⅥA族元素氧、硫、硒对应的氢化物H2O、H2S、H2Se的稳定性依次减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿色化学”的主要内容之一是从技术、经济上设计可行的化学反应,使原子充分利用,不产生污染物.下列化学反应不符合“绿色化学”理念的是
A.制氯乙烷:CH2=CH2+HCl![]() CH3CH2Cl
CH3CH2Cl
B.制甲基丙烯酸甲酯:CH3C≡CH+CO+CH3OH ![]() CH2=C(CH3)COOCH3
CH2=C(CH3)COOCH3
C.制CuSO4:2Cu+O2 = 2CuO,CuO+H2SO4(稀)═CuSO4+H2O
D.制Cu(NO3)2:Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定量的NaOH溶液中逐滴加入AlCl3溶液,生成沉淀Al(OH)3的量随AlCl3加入量的变化关系如图所示。则下列离子组在对应的溶液中一定能大量共存的是
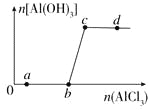
A. a点对应的溶液中:Na+、Fe3+、SO42-、HCO3-
B. b点对应的溶液中:Ag+、Ca2+、NO3-、F-
C. c点对应的溶液中:Na+、S2-、SO42-、Cl-
D. d点对应的溶液中:K+、NH4+、I-、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】空气吹出法工艺是目前“海水提溴”的最主要方法之一。其工艺流程如下:

(1)步骤①中氯气氧化溴离子时在pH=3.5的酸性条件下效果最好,当使用精确pH试纸(能读数到0.1)检测步骤②氯气氧化的溶液的pH时,发现其颜色变化失常,则pH检测失败的原因是 。
(2)步骤④中反应的化学方程式为 ,该反应中体现了SO2的 性(填“氧化”或“还原”)。
(3)步骤⑧中溴蒸气冷凝后得到液溴与溴水的混合物,在实验室可用分液漏斗进行分离。分离时从分液漏斗的上口倒出的是 。
(4)步骤①、②之后并未直接用“含Br2的海水”进行蒸馏得到液溴,而是经过“空气吹出”、“SO2吸收”、“氧化”后再蒸馏,“空气吹出、SO2吸收、氧化”的过程实际上是一个Br2的 过程,与直接蒸馏含Br2的海水相比优点是消耗更少成本降低和 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列应用不涉及氧化还原反应的是( )
A. Na2O2用作呼吸面具的供氧剂 B. 工业上电解熔融状态的Al2O3制备Al
C. 工业上利用合成氨实现人工固氮 D. 实验室用NH4Cl和Ca(OH)2制备NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水是一种重要的自然资源,是人类赖以生存不可缺少的物质.水质优劣直接影响人体健康.请回答下列问题:
(1)天然水中溶解的气体主要有___________、___________;
(2)天然水在净化处理过程中加入的混凝剂可以是___________,其纯净水作用的原理是___________;
(3)水的纯净和软化的区别是___________;
(4)硬度为1°的水是指每升水含10mgCaO或与之相当的物质(如7.1mgMgO).若某天然水中c(Ca2+)=1.2×10-3molL-1,c(Mg2+)=6×10-4molL-1,则此水的硬度为___________;
(5)若(4)中的天然水还含有c(HCO3-1)=8×10-4molL-1,现要软化10m3这种天然水,则需先加入Ca(OH)2 ___________g,后加入Na2CO3 ___________g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com