
分析 ①醋酸钠溶液中氢离子和氢氧根离子均为水电离的;
②结合c酸V酸=c碱V碱及实验操作进行误差分析;
③醋酸是弱电解质,加水稀释醋酸,促进醋酸电离,则n(CH3COO-)、n(H+)增大,n(CH3COOH)减小,但醋酸根离子、氢离子浓度增大的程度小于溶液体积增大的程度,所以c(CH3COO-)、c(H+)、c(CH3COOH)都减小,据此分析解答.
解答 解:①醋酸钠溶液中氢离子和氢氧根离子均为水电离的,已知pH=11,则c(H+)=1×10-11 mol/L,所以水电离的c(OH-)=1×10-3 mol/L;
故答案为:1×10-3 mol/L;
②A.未用标准液润洗碱式滴定管,则消耗的V碱偏大,则酸的浓度偏大,故A选;
B.滴定终点读数时,俯视滴定管的刻度,消耗的V碱偏小,则酸的浓度偏小,故B不选;
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗,酸的物质的量不变,对实验结果无影响,故C不选;
故答案为:A;
③A.加水稀释醋酸促进醋酸电离,氢离子物质的量增大,醋酸分子的物质的量减小,所以$\frac{c(CH{\;}_{3}COOH)}{c(H{\;}^{+})}$的比值减小,故A错误;
B.加水稀释醋酸促进醋酸电离,醋酸根离子物质的量增大,醋酸分子的物质的量减小,则$\frac{c(CH{\;}_{3}COO{\;}^{-})}{c(CH{\;}_{3}COOH)}$的比值增大,故B正确;
C.加水稀释促进醋酸电离,但氢离子浓度减小,温度不变,水的离子积常数不变,所以$\frac{c(H{\;}^{+})}{K{\;}_{W}}$的比值减小,故C错误;
D.加水稀释醋酸促进醋酸电离,氢离子浓度减小,温度不变,水的离子积常数不变,则氢氧根离子浓度增大,$\frac{c(H{\;}^{+})}{c(OH{\;}^{-})}$的比值减小,故D错误;
故答案为:B.
点评 本题考查酸碱混合的计算和定性分析,侧重学生分析能力及计算能力的考查,涉及酸碱混合、pH与浓度的关系等,题目难度中等.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:解答题
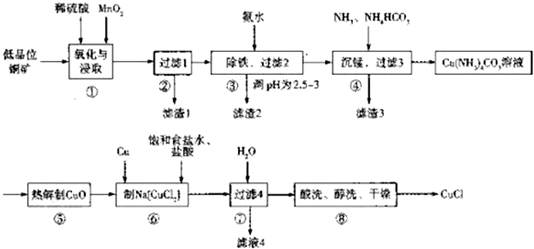
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
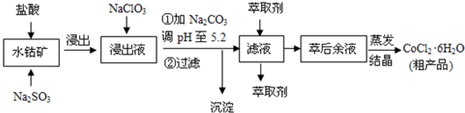
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Ⅰ.(1)某学习小组用0.80mol/L标准浓度的氢氧化钠溶液测定未知浓度的盐酸.
Ⅰ.(1)某学习小组用0.80mol/L标准浓度的氢氧化钠溶液测定未知浓度的盐酸.| 实验编号 | 待测盐酸溶液的体积/mL | 滴入NaOH溶液的体积/mL |
| 1 | 20.00 | 23.00 |
| 2 | 20.00 | 23.10 |
| 3 | 20.00 | 22.90 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 以甲基橙为指示剂滴至溶液由红色变橙色 | |
| B. | 滴定前碱式滴定管尖嘴处有气泡,滴定后气泡消失 | |
| C. | 滴定管读数时,滴定前仰视,终点时俯视 | |
| D. | 振荡时锥形瓶中的液滴溅出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯、氯乙烯、丙烯分子中所有原子均在同一平面 | |
| B. | 汽油、柴油、植物油都是碳氢化合物 | |
| C. | 2-甲基丁烷也称异丁烷 | |
| D. | 乙醇、甲苯和溴苯可用水鉴别 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
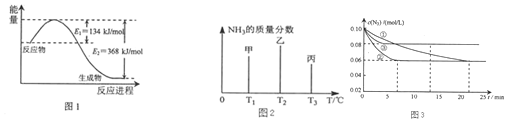
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可用物质的量表示分子、原子、离子、米粒等微粒或小颗粒物质 | |
| B. | 摩尔是国际单位制中的七个基本物理量之一 | |
| C. | 1mol任何物质都含有 6.02×1023个原子 | |
| D. | 0.012Kg12C所含碳原子数为6.02×1023 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com