

(1)烧瓶中发生反应的化学方程式是___________。装置B和C的作用是______________。烧瓶要干燥,放入电石后应塞紧橡皮塞,这是为了___________。容器A中弯曲的导管的作用是_______________。
(2)所用的电石质量不能太大,否则___________;也不能太小,否则___________。若容器B的容积为250 mL,则所用的电石质量应在___________g左右(从以下数据选填:0.30、0.60、1.00、1.50、2.00),(气体体积以标准状况计)。
(3)实验室能否用启普发生器制乙炔___________(“能”或“不能”)。
(4)实验中测得排入量筒中水的体积为V mL(以标准状况计),电石质量为W g。则电石中碳化钙的质量分数是_________(不计算导管中残留的水;气体中饱和水蒸气也忽略不计)。
| 解析(1)(反证法):若A中无弯导管,则烧瓶内气压大于分液漏斗内气压,致使分液漏斗内液体不易滴下。产生的气体进入B,可将B中水排入C,由于V(水)=V(气),所以B、C的作用是测量生成气体的体积。
(2)若电石太大,产生的气体就太多,若V(气)>V(水),则会导致实验失败;若电石太小,产生的气体就太少,就会增大测定误差。 V最大(水)=250 mL n最大(CaC2)=n最大(C2H2)= m最大(CaC2)=64.0 g·mol-1×0.0112 mol=0.717 g 选用电石的质量可为0.60 g。 (3)不能。因为制乙炔的反应是放热反应,且生成的Ca(OH)2易糊住长颈漏斗的下端。 (4)n(CaC2)=n(C2H2)= m (CaC2)= w(CaC2)= 答案:(1)CaC2+2H2O (2)实验失败 误差较大 0.60 (3)不能 (4)
|


科目:高中化学 来源:2013届福建省高一下学期第一学段考试化学试卷 题型:实验题
某校化学研究性学习小组的同学在学习了氨的性质后讨论:运用类比的思想,既然氨气具有还原性,能否像H2那样还原CuO呢?他们设计实验制取氨气并探究上述问题。请你参与该小组的活动并完成下列研究:
(一)制取氨气
(1)写出实验制取氨气的化学方程式 ;
(2)有同学模仿排饱和食盐水收集氯气的方法,想用排饱和氯化铵溶液的方法收集氨气。你认为他能否达到目的? (填“能”或“否”),理由是 。
(二)该小组中某同学设计了如下图所示的实验装置(部分夹持及尾气处理装置未画出),探究氨气的还原性:
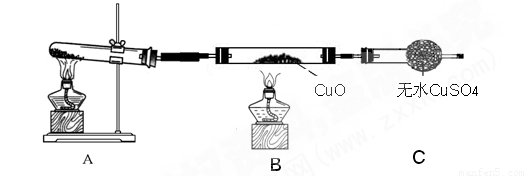 (3)该装置在设计上有一定缺陷,为保证实验结果的准确性,对该装置的改进措施是
(3)该装置在设计上有一定缺陷,为保证实验结果的准确性,对该装置的改进措施是
(4)利用改进后的装置进行实验,观察到CuO变为红色物质,无水CuSO4变蓝色,同时生成一种无污染的气体。写出氨气与CuO反应的化学方程式 。
(三)问题讨论
(5)有同学认为:NH3与CuO反应生成的红色物质可能含有Cu2O。已知:Cu2O是一种碱性氧化物;在酸性溶液中,Cu+ 的稳定性比Cu2+ 差(Cu+ Cu+Cu2+)。请你设计一个简单的实验检验该红色物质中是否含有Cu2O
。
Cu+Cu2+)。请你设计一个简单的实验检验该红色物质中是否含有Cu2O
。
(6)解决了问题(5)后,有同学提出:Cu2O与CuO的热稳定性哪个更强?于是他们进行了如下实验:取98 g Cu(OH)2固体,加热至80℃~100℃时,得到黑色固体粉末,继续加热到1000℃以上,黑色粉末全部变为红色粉末A。冷却后称量,A的质量为72 g。据此可推得,A的化学式为 。由此,得到的结论是________________________________。
查看答案和解析>>
科目:高中化学 来源:期末题 题型:实验题



查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
某校化学研究性学习小组的同学在学习了氨的性质后讨论:运用类比的思想,既然氨气具有还原性,能否像H2那样还原CuO呢?他们设计实验制取氨气并探究上述问题。请你参与该小组的活动并完成下列研究:
(一)制取氨气
(1)写出实验制取氨气的化学方程式 ; (2)有同学模仿排饱和食盐水收集氯气的方法,想用排饱和氯化铵溶液的方法收集氨气。你认为他能否达到目的? (填“能”或“否”),理由是 。
(二)该小组中某同学设计了如下图所示的实验装置(部分夹持及尾气处理装置未画出),探究氨气的还原性:
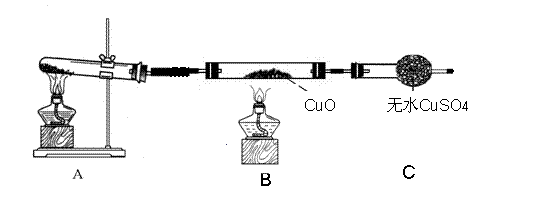 (3)该装置在设计上有一定缺陷,为保证实验结果的准确性,对该装置的改进措施是
(3)该装置在设计上有一定缺陷,为保证实验结果的准确性,对该装置的改进措施是
(4)利用改进后的装置进行实验,观察到CuO变为红色物质,无水CuSO4变蓝色,同时生成一种无污染的气体。写出氨气与CuO反应的化学方程式 。
(三)问题讨论
(5)有同学认为:NH3与CuO反应生成的红色物质可能含有Cu2O。已知:Cu2O是一种碱性氧化物;在酸性溶液中,Cu+ 的稳定性比Cu2+ 差
(Cu+![]() Cu+Cu2+)。请你设计一个简单的实验检验该红色物质中是否含有Cu2O 。
Cu+Cu2+)。请你设计一个简单的实验检验该红色物质中是否含有Cu2O 。
(6)解决了问题(5)后,有同学提出:Cu2O与CuO的热稳定性哪个更强?于是他们进行了如下实验:取98 g Cu(OH)2固体,加热至80℃~100℃时,得到黑色固体粉末,继续加热到1000℃以上,黑色粉末全部变为红色粉末A。冷却后称量,A的质量为72 g。据此可推得,A的化学式为 。由此,得到的结论是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学研究性学习小组拟对一种焰火原料(由两种短周期的常见金属单质组成的合金粉末)进行探究。请完成下列探究报告。
【探究目的】 探究该焰火原料的组成
【资料检索】 ① Mg2+检验方法:取2滴待检液,加入2滴2 mol·L-1 NaOH溶液![]() ,再加入1滴镁试剂(Ⅰ)染料(对硝基苯偶氮苯二酚)。若出现沉淀并吸附镁试剂(Ⅰ)染料呈天蓝色,表示待检液中含有Mg2+。Ag+、Cu2+、Fe3+、NH
,再加入1滴镁试剂(Ⅰ)染料(对硝基苯偶氮苯二酚)。若出现沉淀并吸附镁试剂(Ⅰ)染料呈天蓝色,表示待检液中含有Mg2+。Ag+、Cu2+、Fe3+、NH![]() 会妨碍Mg2+
会妨碍Mg2+![]() 检出。
检出。
② Mg(OH)2可溶于浓的氯化铵溶液,其他的常见不溶碱难溶于氯化铵。
③ 很多合金是金属互化物,有确定的化学组成。
【探究思路】 ① 确定焰火原料所含金属种类;② 测定焰火原料的化学式。
【实验探究】
(1) 甲同学设计实验方案,确定焰火原料中的金属种类,实验记录如下。
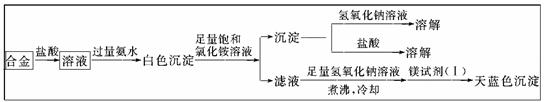
由甲的实验记录![]() 可知,该焰火原料是由
可知,该焰火原料是由![]() ________和________两种金属组成的合金;实验中滤液加入足量氢氧
________和________两种金属组成的合金;实验中滤液加入足量氢氧![]() 化钠溶液后需煮沸,煮沸的理由是___________________。
化钠溶液后需煮沸,煮沸的理由是___________________。
(2)乙同学利用甲同学的结论,设计如下图所示的实验步骤,确定合金组成。

问题讨论:
① 能确定合金组成的数据组有________。(填字母,可以多选)
A. m、n B. m、y C. n、y
② 若合金中相对原子质量较小的金属的物质的量分数为x,金属总物质的量为7 mol,试在下图中作出y随x变化的曲线。
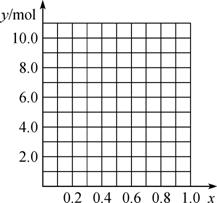
③ 当y=8.5 mol时,该合金是一种金属互化物,其化学式为________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com