
【题目】铁黄是一种重要的颜料,化学式为Fe2O3xH2O,广泛用于涂料、橡胶、塑料、文教用品等工业。实验室模拟工业利用硫酸渣(含Fe2O3及少量的CaO、MgO等)和黄铁矿粉(主要成分为FeS2)制备铁黄的流程如图:

(1)操作Ⅰ与操作Ⅱ中都用到玻璃棒,玻璃棒在两种操作中的作用分别是________、________。
(2)试剂a最好选用______(供选择使用的有:铝粉、空气、浓HNO3);其作用是________。
(3)上述步骤中需用到氨气.下列装置可用于实验室制氨气的是______(填序号)。

(4)检验溶液Z中含有NH4+的方法是________。
(5)查阅资料知,在不同温度下Fe2O3被CO还原,产物可能为Fe3O4、FeO或Fe,固体质量与反应温度的关系如下图所示。

根据图像推断650℃时Fe2O3还原产物的化学式为________,并设计一个简单的实验,证明该还原产物的成分(简述实验操作、现象和结论)________。仪器自选。可供选择的试剂:稀H2SO4、稀盐酸、H2O2溶液、NaOH溶液、KSCN溶液。
【答案】 搅拌加速溶解(或搅拌加速反应) 引流 空气 作氧化剂,将Fe2+氧化为Fe3+ bd 取少量溶液Z置于试管中,滴加过量浓NaOH溶液并微热,将湿润的红色石蕊试纸靠近试管口,试纸变蓝色,证明含有NH4+ FeO 取少量还原产物置于试管中,加入过量稀硫酸(或稀盐酸),固体完全溶解且无气泡产生;再向其中滴加KSCN溶液,溶液不变色;最后滴加H2O2溶液,溶液变红色,证明还原产物为FeO
【解析】
(1)操作Ⅰ与操作Ⅱ中都用到玻璃棒,玻璃棒在两种操作中的作用分别是,操作Ⅰ是利用玻璃棒加速硫酸渣的溶解,操作Ⅱ是过滤实验操作,玻璃棒是起到引流作用。
(2)依据流程分析,试剂a是用来氧化亚铁离子的,但选择氧化剂不能引入新的杂质,铝粉引入新的杂质,浓硝酸做氧化剂会产生污染气体,最好选择空气做氧化剂氧化亚铁离子,不会引入新的杂质,不污染环境。
(3)a、加热氯化铵分解后生成氨气和氯化氢会在试管口重新生成氯化铵,不能制备氨气,a错误;
b、氨水滴入氧化钙固体,氧化钙会和水反应生成氢氧化钙放热,使一水合氨分解生成氨气,b正确;
c、氢氧化钙和氯化铵固体加热时需要试管口略向下倾斜,装置中加热会使生成的水倒流到试管底部炸裂试管,c错误;
d、加热浓氨水会分解生成氨气,可以制取氨气,d正确;
答案为选bd。
(4)溶液Z中含NH4+的实验方法是利用铵根离子和氢氧根离子结合反应生成氨气,氨气能使湿润的红色石蕊试纸变蓝,即取少量溶液Z置于试管中,滴加过量浓NaOH溶液并微热,将湿润的红色石蕊试纸靠近试管口,试纸变蓝色,证明含有NH4+。
(5)开始时氧化铁的物质的量是48g÷160g/mol=0.3mol,当恰好转化为四氧化三铁时质量为![]() ,当恰好转化为氧化亚铁时质量为
,当恰好转化为氧化亚铁时质量为![]() ,即加热温度达到500℃~600℃时还原产物为Fe3O4,当670℃时还原产物为FeO;亚铁离子易被氧化,则验证还原产物的实验操作是取少量还原产物置于试管中,加入过量稀硫酸(或稀盐酸),固体完全溶解且无气泡产生;再向其中滴加KSCN溶液,溶液不变色;最后滴加H2O2溶液,溶液变红色,证明还原产物为FeO。
,即加热温度达到500℃~600℃时还原产物为Fe3O4,当670℃时还原产物为FeO;亚铁离子易被氧化,则验证还原产物的实验操作是取少量还原产物置于试管中,加入过量稀硫酸(或稀盐酸),固体完全溶解且无气泡产生;再向其中滴加KSCN溶液,溶液不变色;最后滴加H2O2溶液,溶液变红色,证明还原产物为FeO。


 53天天练系列答案
53天天练系列答案科目:高中化学 来源: 题型:
【题目】在2 L密闭容器内,t℃时发生反应:N2(g)+3H2(g)![]() 2NH3(g),在体系中,n(N2)随时间的变化如下表:
2NH3(g),在体系中,n(N2)随时间的变化如下表:
时间(min) | 0 | 1 | 2 | 3 | 4 | 5 |
N2的物质的量(mol) | 0.20 | 0.10 | 0.08 | 0.06 | 0.06 | 0.06 |
(1)上述反应在第5min时,N2的转化率为_______________________;
(2)用H2表示从0~2 min内该反应的平均速率v(H2)=_____________;
(3)t℃时,在4个均为2L密闭容器中不同投料下进行合成氨反应。根据在相同时间内测定的结果,判断该反应进行快慢的顺序为______________。(用字母填空,下同);
a.v(NH3)=0.05 mol·L-1·min-1 b.v(H2)=0.03 mol·L-1·min-1
c.v(N2)=0.02 mol·L-1·min-1 d.v(H2)=0.00 l mol·L-1·s-1
(4)下列表述能作为反应达到化学平衡状态的标志是_____________。
a.反应速率v(N2):v(H2):v(NH3)=1:3:2
b.各组分的物质的量浓度不再改变
c.混合气体的平均相对分子质量不再改变
d.混合气体的密度不变
e.单位时间内生成n mol N2的同时,生成3n mol H2
f.v(N2)消耗=2v(NH3)消耗
g.单位时间内3mol H—H键断裂的同时2mol N—H键也断裂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作或对实验事实的叙述不正确的是( )
A. 可用稀硝酸清洗做过银镜反应实验的试管
B. 用NaOH溶液可鉴别分别含Na+、Mg2+、Al3+、Fe2+、Fe3+、NH4+阴离子的溶液
C. 向沸腾的NaOH稀溶液中逐滴滴加FeCl3饱和溶液,可制备Fe(OH)3胶体
D. 配制浓硫酸和浓硝酸的混合酸时,应将浓硫酸沿器壁慢慢加入到浓硝酸中,并不断搅拌
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】试判断下列物质能否溶于水,能溶于水的组合是( )
①葡萄糖 ②己六醇 ③硬脂酸 ④硬脂酸钠 ⑤硬脂酸镁 ⑥乙二酸 

A. ①②④⑥⑦⑨ B. 全溶 C. 除⑤⑧外全溶 D. ①④⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.(1)电化学降解NO3-的原理如图1所示,电源正极为_____ (填“a”或“b”); 阴极电极反应式为____.

Ⅱ.工业上利用合成气(主要成分为CO、CO2和H2) 在催化剂的作用下合成甲醇。已知298K 和101KPa 条件下:
2H2(g)+O2(g)= 2H2O(1) ΔH1= -571.6kJ/mol
CO(g)+1/2O2(g)= CO2(g) ΔH2= -283.0kJ/mol
CH3OH(1)+3/2O2(g)=CO2(g) +2H2O(1) ΔH3= -726.5kJ/mol
(2)则CO(g)+2H2 (g) ![]() CH3OH(1) ΔH=____kJ/mol
CH3OH(1) ΔH=____kJ/mol
(3)已知:CH3OH(1) =CH3OH(g) ΔH=+35.2kJ/mol;
CO(g)+2H2(g) ![]() CH3OH(g)平衡常数K 随温度变化关系的曲线为图2 中的______(填曲线标记字母Ⅰ或II)。
CH3OH(g)平衡常数K 随温度变化关系的曲线为图2 中的______(填曲线标记字母Ⅰ或II)。

(4)维持反应温度为510K,以n(H2)/n(CO)=2:1充入一定量的原料气于1 L容器中,在上述条件下充分反应,t1时刻达到平衡测得容器中c(CH3OH)=2mol/L.则平衡时CO 转化率=______;若维持反应温度为520K,其它条件不变,请在图3中画出c(CO)在0~t1时刻变化曲线。__________________
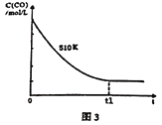
(5)20世纪90年代,化学家研制出新型催化剂: 碱金属的醇盐及溶剂用于合成甲醇。图4是在该新型催化剂作用下,研究温度、压强对合成甲醇的影响。由图可知适宜的反应温度、压强分别为_____ (填字母)。
温度A.90-150℃ B.200-260℃ C.300-360℃ D.400-460℃
压强E.0.1~1MPa F.3~5 MPa G.8~10MPa H.15~20MPa

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为实验室制取乙酸乙酯的装置。请回答:

(1) 导管右端管口不伸入液面以下的原因是_______。
(2) 浓硫酸的作用是_________。
(3) 下列有关该实验的说法中,正确的是_______。
A.向a 试管中加入沸石,其作用是防止加热时液体暴沸
B.饱和碳酸钠溶液可以除去产物中混有的乙酸
C.乙酸乙酯是一种无色透明、密度比水大的油状液体
D.若原料为CH3COOH 和CH3CH218OH,则乙酸乙酯中不含18O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的镁铝合金投入100 mL一定物质的量浓度的盐酸中,合金全部溶解,向所得溶液中滴加5 mol/L NaOH溶液至过量,生成沉淀的质量与加入氢氧化钠溶液的体积的关系如图所示。

(1)当沉淀达到最大值时,Al(OH)3的质量;
(2)原合金中Mg的质量;
(3)盐酸的物质的量浓度。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质,按化合物、单质、混合物顺序排列的是
A. 纯碱、液态氧、碘酒 B. 生石灰、单晶硅、熟石灰
C. 干冰、铜、氨气 D. 空气、氮气、明矾
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com