
 碳、氮在自然界中广泛存在.
碳、氮在自然界中广泛存在.分析 (1)CH3COOH中C原子分别形成4个、3个δ键,没有孤对电子,CH3CHOOH分子中含有1个C-C、3个C-H、1个C-O、1个C=O、1个O-H等化学键;
(2)主族元素中,原子核外电子层数与其周期数相等,原子核外最外层电子数与其主族族序数相等;根据能量最低原理书写核外电子排布;
(3)根据SnCl4分子结构中Cl原子的分布位置,若形成立体结构则为正四面体结构,若与Sn原子在同一平面则为平面正方形结构;
(4)H2O电子数为10,H2O与CH3CH3OH都含有氢键,且都为极性分子,二者互溶;
(5)①根据均摊法计算晶胞中Xn+、N3-离子数目进行解答;
②结合①中计算,在利用化合价代数和为0计算;
③以顶角上的N3-为中心,晶胞中与之距离最近的Xn+有3个,而每个顶点为8个晶胞共用,棱上原子为4个晶胞所共用,所以每个原子为1个晶胞提供$\frac{1}{4}$.
解答 解:(1)CH3COOH中C原子分别形成4个、3个δ键,没有孤对电子,分别为sp3杂化、sp2杂化,CH3CHOOH分子中含有1个C-C、3个C-H、1个C-O、1个C=O、1个O-H等化学键,则1mol CH3COOH分子中含有σ键的数目为7mol或7×6.02×1023,
故答案为:sp3和sp2;7mol或7×6.02×1023;
(2)50号元素Sn在周期表中位置是第五周期第ⅣA族,50号元素Sn的基态原子核外电子排布式为1s22s22p63s23p63d104s24p64d105s25p2或[Kr]4d105s25p2,故答案为:第五周期第ⅣA族;1s22s22p63s23p63d104s24p64d105s25p2或[Kr]4d105s25p2;
(3)SnCl4分子中Cl原子的位置有所不同,根据分子结构中Cl原子的分布位置,若形成立体结构则为正四面体结构,若Cl原子与Sn原子在同一平面则为平面正方形结构,故答案为:正四面体结构;平面正方形结构;
(4)与H2O所含电子数相同的一种含碳的阳离子为CH5+,H2O与CH3CH3OH都含有氢键,且都为极性分子,二者互溶,
故答案为:CH5+;H2O与CH3CH3OH之间可以形成氢键;
(5)①晶胞中Xn+可知数目为12×$\frac{1}{4}$=3、N3-离子数目为8×$\frac{1}{8}$=1,故该晶体的阳离子与阴离子个数比为3:1,故答案为:3:1;
②由化合价代数和为0,可知3n-3=0,故n=1,故答案为:1;
③以顶角上的N3-为中心,晶胞中与之距离最近的Xn+有3个,而每个顶点为8个晶胞共用,棱上原子为4个晶胞所共用,所以每个原子为1个晶胞提供$\frac{1}{4}$,故则每个N3-周围与之距离最近的X+数目为:8×3×$\frac{1}{4}$=6,故答案为:6.
点评 本题考查了元素周期表及应用、化学键、杂化类型以及晶胞结构及计算,注意利用均摊法进行晶胞有关计算,需要学生具有一定空间想象能力,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | C4H8或C5H8 | B. | C3H8或C5H8 | C. | C4H8或C3H8 | D. | C5H8或C6H10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
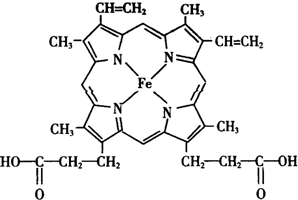 人类很早就懂得使用铁器,如今对铁元素的研究依然热度不减.请回答:
人类很早就懂得使用铁器,如今对铁元素的研究依然热度不减.请回答: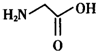 ),其分子中σ键和π键的个数比为9:1.
),其分子中σ键和π键的个数比为9:1.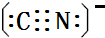 ,与其配体互为等电子体的微粒有N2、CO(任写两种,填化学式).
,与其配体互为等电子体的微粒有N2、CO(任写两种,填化学式).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C5H10O2的酯类 | B. | 分子式为C5H10的烯烃 | ||
| C. | 分子式为C5H12O的醇类 | D. | 分子式为C5H12的所有化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
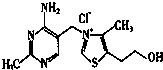 请回答下列问题:
请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
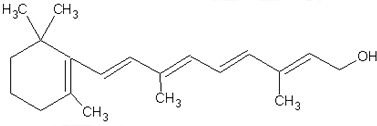
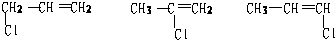 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某同学利用下列实验装置图探究铜与稀硝酸反应的还原产物并进行喷泉实验(假设药品足量),请回答下列问题:
某同学利用下列实验装置图探究铜与稀硝酸反应的还原产物并进行喷泉实验(假设药品足量),请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
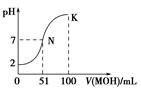 常温下,向100mL 0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法中错误的是( )
常温下,向100mL 0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法中错误的是( )| A. | HA为一元强酸 | |
| B. | MOH为一元弱碱 | |
| C. | N点水的电离程度大于K点水的电离程度 | |
| D. | K点对应的溶液中:c(MOH)+c(OH-)-c(H+)=0.01 mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com