
| Ksp | 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 2.6×10-39 | 1.9 | 3.2 |
| Cu2+ | 2.2×10-20 | 4.7 | 6.7 |
| ||
| ||
| 1 |
| 2 |
| ||
| ||
| ||
| 1 |
| 2 |


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:阅读理解
| 沸腾炉温度/℃ | 560 | 580 | 600 | 620 | 640 | 660 |
| 生成物中含水溶性铜化合物的百分含量/% | 90.12 | 91.24 | 93.50 | 92.38 | 89.96 | 84.23 |
| 生成物中含酸溶性铜化合物的百分含量/% | 92.00 | 93.60 | 97.08 | 97.82 | 98.16 | 98.19 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的 pH | |
| Fe3+ Cu2+ |
1.9 4.7 |
3.2 6.7 |
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2011-2012学年山东省高三5月高考冲刺理科综合化学试卷(解析版) 题型:简答题
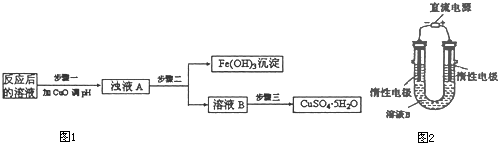
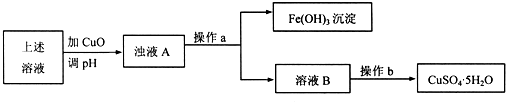
(12分)浸出-萃取-电积法已成为铜湿法冶金的主要工艺过程。以黄铜铜为原料,采用电积法生产阴极铜生产线,主要生产工艺为:
黄铜铜→硫酸浸出→过滤→萃取→反萃→电积→阴极铜。
(1)浸出是用浸矿剂将铜矿石中的铜进入溶液中。据报道, 有一种叫Thibacillus Ferroxidans的细菌在氧气存在下,酸性溶液中,将黄铜矿氧化成硫酸盐,写出用硫酸浸出黄铜矿发生反应的离子方程式: 。
(2)萃取是利用特效铜萃取剂在含铜、铁及其碱性金属离子的低浓度含杂浸出液中有选择性地使铜离子萃入有机相,将铜离子与其它金属离子有效地分离,并通过反萃取使低浓度铜离子的原液富集成适宜电积要求的硫酸铜溶液。萃取过程的化学平衡为:2RH+Cu2+ R2Cu+2H+。则萃取和反萃取进行的程度受
和
的影响。
R2Cu+2H+。则萃取和反萃取进行的程度受
和
的影响。
(3)电积是将萃取富集后的铜溶液电解沉积出阴极铜。右图为用惰性阳极电积阴极铜的装置图:

①在图示方框中标出电源的正负极。
②写出电积阴极铜的总反应 。
(4)金属铜长期露置于空气中容易生锈,铜锈的主要成分为 ,请利用电化学原理画出防止铜腐蚀的装置图。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com