
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
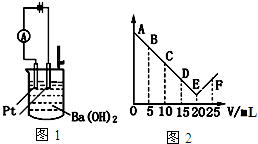
| A. | 此酸的化学式为HNO3 | |
| B. | 处于C点时溶液中导电的阳离子主要是Ba2+、NH4+ | |
| C. | 烧杯中刚加入酸时,观察不到有白色沉淀生成 | |
| D. | 从A→E电流强度I变小的主要原因是生成难溶的盐和难电离的水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 1:2 | C. | 1:3 | D. | 3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉既可做漂白棉麻纸张的溧白剂,又可做游泳池及环境的消毒剂 | |
| B. | 氮肥包括铵态氮肥、硝态氮肥和尿素 | |
| C. | 浓硫酸溅到皮肤上时立即用稀氢氧化钠溶液冲洗 | |
| D. | 硅胶可用作食品干燥剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2+ | B. | Al | C. | HCO${\;}_{3}^{-}$ | D. | CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH小于7的雨水被称为酸雨 | |
| B. | 推广使用燃煤脱硫技术,主要是为了防治SO2污染 | |
| C. | 为防止富脂食品因被氧化而变质,常在包装袋中放入生石灰或硅胶 | |
| D. | 明矾溶于水可产生具有吸附性的胶体粒子,常用于饮用水的杀菌消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
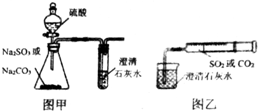 某同学用图甲所示的装置来探究CO2、SO2与澄清石灰水的反应,结果通入CO2时可以看到先浑浊后澄清的现象,但通入SO2没有看到浑浊现象.经过思考分析,该同学改用图乙的装置,将气体收集在注射器中,缓慢地将气体一个气泡一个气泡地通入澄清石灰水中,结果都能看到石灰水先变浑浊再澄清的现象,且通入SO2产生的现象明显比通入CO2快.
某同学用图甲所示的装置来探究CO2、SO2与澄清石灰水的反应,结果通入CO2时可以看到先浑浊后澄清的现象,但通入SO2没有看到浑浊现象.经过思考分析,该同学改用图乙的装置,将气体收集在注射器中,缓慢地将气体一个气泡一个气泡地通入澄清石灰水中,结果都能看到石灰水先变浑浊再澄清的现象,且通入SO2产生的现象明显比通入CO2快.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
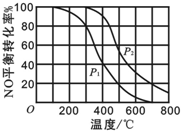 (1)汽车尾气是造成空气污染产生雾霾的原因之一.其中涉及的反应2NO(g)+O2?2NO2(g)在其他条件不变达平衡时.分别测得NO的平衡转化率在不同压强(P1、P2)下温度变化的曲线如图所示.
(1)汽车尾气是造成空气污染产生雾霾的原因之一.其中涉及的反应2NO(g)+O2?2NO2(g)在其他条件不变达平衡时.分别测得NO的平衡转化率在不同压强(P1、P2)下温度变化的曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
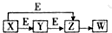 如图是某常见元素M的单质及其化合物间的转化关系图,其中X、Y、Z、W四种物质中均含有元素M,E是另一种单质,下列有关说法中不正确的是( )
如图是某常见元素M的单质及其化合物间的转化关系图,其中X、Y、Z、W四种物质中均含有元素M,E是另一种单质,下列有关说法中不正确的是( )| A. | W可能是硫酸 | B. | Y不可能是Mg | C. | X可能是钠 | D. | Z可能是CO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com