
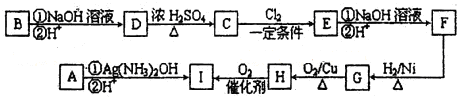
 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:
 研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,利用如图所示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛.下列说法中,正确的是( )
研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,利用如图所示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛.下列说法中,正确的是( )| A、由TiO2制得1mol金属Ti,理论上外电路转移2 mol电子 |
| B、阳极的电极反应式为:C+2O2--4e-═CO2↑ |
| C、在制备金属钛前后,整套装置中CaO的总量减少 |
| D、若用铅蓄电池作该装置的供电电源,“+”接线柱应连接Pb电极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用氨水鉴别Al3+、Mg2+和Ag+ |
| B、用Ba(NO3)2溶液鉴别Cl-、SO42-和CO32- |
| C、用水鉴别乙醇、甲苯、硝基苯 |
| D、用KMnO4酸性溶液鉴别苯、甲苯、环己烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、杂质一定不含KNO3 |
| B、杂质一定含有Ba(NO3)2可能还含有KNO3 |
| C、杂质一定不含Na2SO4 |
| D、杂质一定含KNO3可能还含有Na2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
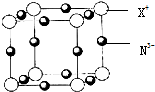 氮是地球上极为丰富的元素.
氮是地球上极为丰富的元素.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电解饱和食盐水制烧碱采用离子交换膜法,可以阻止阳离子通过 |
| B、在铁上镀锌时,锌棒作阴极,且电解液硫酸锌的浓度是不变的 |
| C、用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1:2 |
| D、用惰性电极电解饱和NaCl溶液,若有1mol电子转移,则生成1mol NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、稀醋酸溶液中 |
| B、氢氧化钙悬浊液中 |
| C、二氧化硫与氧气反应的混合物中 |
| D、稀氯化钠水溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com