
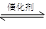 2CO2+N2
2CO2+N2| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/ mol·L-1 | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)/ mol·L-1 | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
 0(填写“>”、“<”、“=”)。
0(填写“>”、“<”、“=”)。| 实验编号 | T/℃ | NO初始浓度 mol·L-1 | CO初始浓度 mol·L-1 | 催化剂的比表面积 ㎡·g-1 |
| Ⅰ | 280 | 1.2×10-3 | 5.8×10-3 | 82 |
| Ⅱ | | | 5.8×10-3 | 124 |
| Ⅲ | 350 | 1.2×10-3 | | |
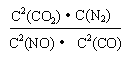 (2分)
(2分)

科目:高中化学 来源:不详 题型:单选题
| A.甲>乙 | B.甲<乙 | C.甲=乙 | D.无法确定 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.刚充入时反应速率υ正减少,υ逆增大 |
| B.平衡不发生移动 |
| C.平衡向逆反应方向移动 |
| D.物质C的质量分数增大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.工业生产硫酸的过程中使用适当过量氧气,以提高SO2的转化率 |
| B.氢气、碘蒸气、碘化氢气体组成的平衡体系加压后气体颜色变深 |
| C.实验室用排饱和NaHCO3溶液的方法收集CO2气体 |
| D.新制氯水中,滴加硝酸银溶液,溶液颜色变浅,产生白色沉淀 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CO(g)+3H2(g);△H>0
CO(g)+3H2(g);△H>0| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
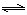 H2(g)+CO2(g),该反应平衡常数随温度的变化如下:
H2(g)+CO2(g),该反应平衡常数随温度的变化如下:查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 C(g)+D(g),其中a为正整数。反应过程中,当其他条件不
C(g)+D(g),其中a为正整数。反应过程中,当其他条件不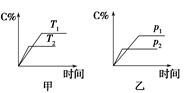
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 项目 | H2 | N2 | NH3 |
| 起始时 | 5 mol·L-1 | 3 mol·L-1 | 0 |
| 2 s末 | 2 mol·L-1 | | |

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2NH3(g) ΔH=Q kJ·mol-1,能量变化如下图,回答下列问题:
2NH3(g) ΔH=Q kJ·mol-1,能量变化如下图,回答下列问题:
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CO(NH2)2(s)+H2O(g)
CO(NH2)2(s)+H2O(g) | 物质的量mol | 0min | 2 min | 3 min | 4 min |
| NH3 | 2.0 | 1.4 | n1 | n1 |
| CO2 | 1.0 | 0.7 | n2 | n2 |
| H2O | 0 | 0.3 | n3[ | n3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com