
由短周期元素形成的化合物A2B3,A3+比B2-少一个电子层。则下列说法中正确的是
A.A2B3是三氧化二铝 B.A3+和B2-最外层上的电子数相等
C.A、B不在同一周期 D.B是第三周期第ⅣA族的元素
科目:高中化学 来源: 题型:
下图表示有关物质(均由短周期元素形成)之间的转化关系,其中A为常见的金属单
![]() 质,B为非金属单质(一般是黑色粉末),C是常见的无色无味液体,D是淡黄色的固体化
质,B为非金属单质(一般是黑色粉末),C是常见的无色无味液体,D是淡黄色的固体化
![]() 合物。(反应条件图中已省略。)
合物。(反应条件图中已省略。)
![]()
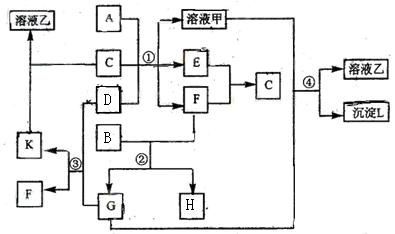
![]() (1)A、B、C、D代表的物质分别为 、 、 、 (填化学式);
(1)A、B、C、D代表的物质分别为 、 、 、 (填化学式);
![]() (2)反应①中的C、D均过量,该反应的化学方程式是 ;
(2)反应①中的C、D均过量,该反应的化学方程式是 ;
![]() (3)反应②中,若B与F物质的量之比为4∶3,G、H分别是 、 (填化学式);
(3)反应②中,若B与F物质的量之比为4∶3,G、H分别是 、 (填化学式);
![]() (4)反应③产物中K的化学式为 ;
(4)反应③产物中K的化学式为 ;
![]() (5)反应④的离子方程式为 。
(5)反应④的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年黑龙江省哈四中高二下学期第一次(4月)月考化学试卷(带解析) 题型:填空题
a、b、c、d、e、f、g、h为8种由短周期元素构成的微粒,它们都有10个电子,其结构特点如下:
| 微粒代码 | a | b | c | d | e | f | g | h |
| 原子核个数 | 单核 | 单核 | 双核 | 多核 | 单核 | 多核 | 多核 | 多核 |
| 带电荷数(单位:电荷) | 0 | +1 | -1 | 0 | +2 | +1 | 0 | +1 |
查看答案和解析>>
科目:高中化学 来源:2014届黑龙江省高二下学期第一次(4月)月考化学试卷(解析版) 题型:填空题
a、b、c、d、e、f、g、h为8种由短周期元素构成的微粒,它们都有10个电子,其结构特点如下:
|
微粒代码 |
a |
b |
c |
d |
e |
f |
g |
h |
|
原子核个数 |
单核 |
单核 |
双核 |
多核 |
单核 |
多核 |
多核 |
多核 |
|
带电荷数(单位:电荷) |
0 |
+1 |
-1 |
0 |
+2 |
+1 |
0 |
+1 |
其中b的离子半径大于e的离子半径,d是由极性键构成的四原子分子;c与f可形成两个共价型g分子,d微粒和h微粒在一定条件下可互相转化,试写出:?
(1)a微粒原子核外结构示意图:___________,该元素属于周期表中的_____区。
c微粒电子式为 ___________。?
(2)b与e相应元素的最高价氧化物对应水化物的碱性强弱比较为:
________>___________(写化学式)?
(3)c微粒和f微粒反应生成2分子g的离子方程式为_____________________。?
(4)大量c微粒和大量h微粒共热生成d微粒的离子反应方程式为______________。?
(5)微粒g中心原子杂化方式为_______ ;d微粒分子结构呈__________型;
查看答案和解析>>
科目:高中化学 来源:宁夏自治区高考真题 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:
下图所示的框图中,A-I都是由短周期元素组成的常见物质。其中A是气体,它的水溶液呈碱性;氧化物D和氧化物F都易与人体血液中的血红蛋白结合而使人中毒;单质E可作半导体材料。
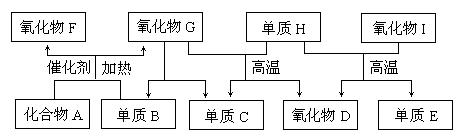
(1)化合物A的化学式是 ,氧化物G的电子式是 。
(2)组成单质E的元素在元素周期表中的位置是 ;单质H和单质E以及氧化物I 均能形成 (填“分子”、“原子”或“离子”)晶体,其中单质E的熔点 (填“高于”、“低于”或“等于”)氧化物I的熔点。
(3)标准状况下,将2.24L氧化物F和1.68L单质B同时通入1L氧化物G中(反应前后溶液体积的变
化忽略不计),发生反应的化学方程式为 ,所得溶液的PH= 。此时再向溶液
中通入2.24L化合物A,完全反应后所得溶液的PH (填“>7”、“<7”或“=7”),用离子方程式
表示其原因: 。
(4)单质B和单质C在一定条件下可组成原电池(用KOH溶液作电解质),则该原电池负极的电极反应式为
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com