
分析 (1)硫酸氢钠溶液中完全电离出钠离子、氢离子、硫酸根离子,氢离子和铁锈氧化铁发生反应生成铁离子和水;
(2)依据化学方程式定量关系计算,元素化合价升高失电子发生氧化反应,被氧化得到氧化产物,利用亚铁离子的还原性可以选择高锰酸钾溶液检验;
(3)设此氧化物化学式为FexOy,利用元素守恒书写化学方程式,利用直平法配平书写化学方程式得到氧化物化学式;
(4)草酸亚铁与重铬酸钾反应K2Cr2O7+2FeC2O4+7H2SO4=Fe2(SO4)3+Cr2(SO4)3+K2SO4+7H2O+4CO2↑,wg草酸亚铁(FeC2O4)样品中含有FeC2O4的质量为
c1mol•L-1×V×10-3L×2×$\frac{250ml}{20ml}$×144g/mol=3.6c1V g,草酸亚铁样品纯度为 $\frac{3.6{c}_{1}Vg}{wg}$×100%.
解答 解:(1)焊接时,可用硫酸氢钠溶液清洗铁表面的锈迹,相关反应的离子方程式为:Fe2O3+6H+=2Fe3++3H2O,故答案为:Fe2O3+6H+=2Fe3++3H2O;
(2)Fe3C+22HNO3═3Fe(NO3)3+CO2↑+13NO2↑+11H2O,当生成标准状况下11.2LCO2时,n(CO2)=$\frac{11.2L}{22.4L/mol}$=0.5mol,被氧化的Fe3C的物质的量为0.5mol,通过实验检验该反应进行完全后是否有Fe2+生成,可以选择高锰酸钾溶液检验,取反应后的固体溶解,滴入高锰酸钾溶液,若褪色证明生成亚铁离子,不褪色证明无亚铁离子生成,
故答案为:0.5mol,酸性高锰酸钾溶液;
(3)一定质量的某铁的氧化物FexOy,与足量4mol•L-1的稀盐酸充分反应,生成的FeCl2与FeCl3物质的量之比为1:2,依据元素守恒得到反应的化学方程式为:FexOy+8HCl=FeCl2+2FeCl3+4H2O,得到x=3,y=4,铁的氧化物化学式为:Fe3O4,
故答案为:Fe3O4;
(4)草酸亚铁与重铬酸钾反应K2Cr2O7+2FeC2O4+7H2SO4=Fe2(SO4)3+Cr2(SO4)3+K2SO4+7H2O+4CO2↑,则
wg草酸亚铁(FeC2O4)样品中含有FeC2O4的物质的量为c1mol•L-1×V×10-3L×2,
质量为c1mol•L-1×V×10-3L×2×$\frac{250ml}{20ml}$×144g/mol=3.6c1V g,
草酸亚铁样品纯度为$\frac{3.6{c}_{1}Vg}{wg}$×100%=$\frac{360{c}_{1}V}{w}$%,
故答案为:$\frac{360{c}_{1}V}{w}$%.
点评 本题考查了氧化还原反应分析、化学式的计算应用,、滴定实验的理解和含量计算过程,注意实验过程中溶液体积的变化,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 因地制宜开发利用风能、水能、地热能、潮汐能 | |
| B. | 大力推广并充分利用太阳能 | |
| C. | 合理、安全开发利用氢能、核能 | |
| D. | 能源都是通过化学反应获得的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6 | B. | 5 | C. | 4 | D. | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 氯水滴入下列溶液中 | 实验现象 | 结论 |
| A | 滴有KSCN的FeC12溶液 | 变红 | C12具有还原性 |
| B | 滴有石蕊的NaOH溶液 | 褪色 | C12具有酸性 |
| C | 紫色石蕊溶液 | 先变红后褪色 | C12具有漂白性 |
| D | KI淀粉溶液 | 变蓝 | C12具有氧化性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑤ | B. | ②④ | C. | ①②⑤ | D. | ②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
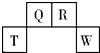 短周期元素T、Q、R、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族族序数相等.它们的最高价氧化物的水化物依次为甲、乙、丙、丁.下列叙述不正确的是( )
短周期元素T、Q、R、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族族序数相等.它们的最高价氧化物的水化物依次为甲、乙、丙、丁.下列叙述不正确的是( )| A. | R的氢化物可以既有极性键又有非极性键 | |
| B. | 常温下丁的浓溶液可用T单质所制的容器来盛装 | |
| C. | 丁的浓溶液与Q的单质加热发生反应,可生成体积比为1:2的两种气体 | |
| D. | 甲、乙、丙、丁受热均易分解 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
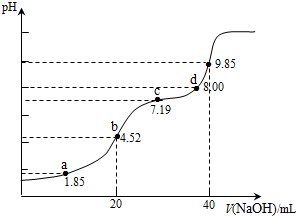
| A. | a点所得溶液中:2c(H2SO3)+c(SO32-)=0.1 mol•L-1 | |
| B. | b点所得溶液中:c(H2SO3)+c(H+)=c(SO32-)+c(OH-) | |
| C. | c点所得溶液中:c(Na+)<3c($HS{{{O}_{3}}^{-}}_{\;}$) | |
| D. | d点所得溶液中:c(Na+)>c(SO32-)>c(HSO3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 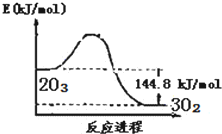 O3转变为O2能量曲线可用图表示 | |
| B. | O3转变为O2为氧化还原反应 | |
| C. | 臭氧层中氟里昂释放出的氯原子是O3分解的催化剂 | |
| D. | t℃时,3O2(g)?2O3(g),K′≈3.33×10-77 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与稀硫酸反应 Fe+2H+═Fe3++H2↑ | |
| B. | 氯化铝溶液与氨水反应:Al3++3OH-═Al(OH)3↓ | |
| C. | 碳酸钙与稀盐酸反应:CO32-+2H+═H2O+CO2↑ | |
| D. | 氢氧化铝与足量盐酸反应 Al(OH)3+3H+═Al3++3H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com