
【题目】Fe、Si金属间化合物是近几年研究的热点材料,它在电子学、热电、光电和磁学等领域有着广泛的应用,另外铁的配合物也有极其广泛的用途。回答下列问题:
(1)铁的一种配合物的化学式为[Fe(Htrz)3](ClO4)2,其中Htrz为1,2,4–三氮唑(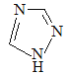 )。
)。
①配合物中阴离子空间构型为________,中心原子的杂化方式是________。
②Htrz分子中含σ键数为______个,其与Fe2+形成配位键的原子是_______。
③1,2,4–三氮唑与环戊二烯(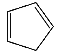 )的物理性质如下:
)的物理性质如下:
环戊二烯 | 1,2,4–三氮唑 | |
相对分子质量 | 66 | 69 |
物理性质 | 无色液体,不溶于水,沸点为42.5℃ | 无色晶体,溶于水,沸点为260℃ |
它们的水溶性和沸点差异很大的主要原因是________________________。
(2)一种Fe、Si金属间化合物的晶胞结构如下图所示:

晶胞中含铁原子为_____个,已知晶胞参数为0.564nm,阿伏加德罗常数的值为NA,则Fe、Si金属间化合物的密度为___________g·cm–3(列出计算式)
【答案】正四面体型 sp3 8 N 1,2,4–三氮唑分子间、与水分子间都可以形成氢键 12 ![]()
【解析】
根据价层电子对互斥模型分析微粒空间构型及轨道杂化类型;根据配体的结构判断σ键数目;根据氢键对物质物理性质的影响分析;根据晶胞结构计算晶胞密度。
(1)①ClO4-的价电子对数为(7+1)/2=4,Cl原子上没有孤电子对,空间构型为正四面体型,Cl原子采用sp3杂化;
② 环上有5个σ键,环外有3个σ键,共8个σ键;Htrz分子中只有N原子有孤电子对,H、C无孤对电子,所以与Fe2+形成配位键的原子是N;
环上有5个σ键,环外有3个σ键,共8个σ键;Htrz分子中只有N原子有孤电子对,H、C无孤对电子,所以与Fe2+形成配位键的原子是N;
③两者结构相似,相对分子质量非常接近,但Htrz分子中有N-H键,N原子半径小,电负性大,分子间可以形成氢键,也可以与水分子间形成氢键,所以它们的水溶性和沸点差异很大的主要原因是:1,2,4–三氮唑分子间、与水分子间都可以形成氢键;
(2)Fe在顶点有8个,面心有6个,棱上有12个,体内有4个,体心有1个,共含8×1/8+6×1/2+12×1/4+4+1=12个,N原子有4个,晶胞的质量m=(12×56+4×28)/NAg,体积为V=(0.564×10-7)3cm3,ρ=m/V=![]() g/cm3。
g/cm3。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】将一定质量的Mg和Al混合物投入到200 mL稀硫酸中,固体全部溶解后,向所得溶液中滴加NaOH溶液至过量,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示。则下列说法错误的是
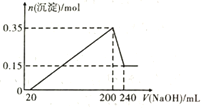
A.最初20 mL NaOH溶液用于中和过量的稀硫酸
B.NaOH溶液物质的量浓度为![]()
C.Mg和Al的总质量为9g
D.生成的氢气在标准状况下的体积为11.2 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅是重要的无机非金属材料,工业上从硅的氧化物制取硅单质的主要反应为SiO2+2C=Si+2CO↑。其中,其中硅元素的化合价_______(填“升高”或“降低”),氧化剂是_____(填化学式),被氧化的物质是____(填化学式);若反应中消耗了2molC,则生成_____molSi。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课题组以甲苯为主要原料,采用以下路线合成镇静催眠药物——苯巴比妥:
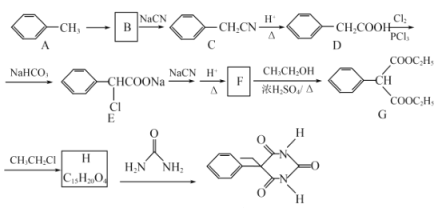
已知:![]() 。回答下列问题:
。回答下列问题:
(1)写出H的结构简式______________________。H→苯巴比妥的反应类型_________________。
(2)写出F→G的化学方程式________________________________。
(3)下列说法正确的是__________。
a.B的核磁共振氢谱有5组峰
b.化合物E能发生取代,氧化、加成、消去等反应
c.尿素在一定条件下可水解生成![]() 和
和![]()
d.苯巴比妥的分子式为![]()
(4)F制备G时会生成副产物![]() ,写出符合下列条件的M的同分异构体的结构简式: ___________________。
,写出符合下列条件的M的同分异构体的结构简式: ___________________。
①除苯环外不含其它环状结构。且苯环上有3个取代基;
②核磁共振氢谱图显示有5种化学环境不同的氢原子;
③该物质可发生银镜反应与水解反应,且1mol该物质完全水解时需要2molNaOH。
(5)以乙醇为原料可合成![]() ,请设计合成路线(用流程图表示,无机试剂任选)。___________
,请设计合成路线(用流程图表示,无机试剂任选)。___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Li、Na、Mg、C、N、O、S等元素的研究一直在进行中,其单质及化合物在诸多领域都有广泛的应用。回答下列问题:
(1)钠在火焰上灼烧的黄光是一种_____(填字母)
A.吸收光谱;B.发射光谱。
(2)H2S的VSEPR模型为________,其分子的空间构型为________;结合等电子体的知识判断离子N3–的空间构型为________。
(3)Li2O是离子晶体,其晶格能可通过下图的Born-Haber循环计算得到。
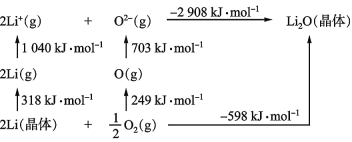
可知Li2O晶格能为______kJ·mol-1。
(4)N、O、Mg元素的前3级电离能如下表所示:
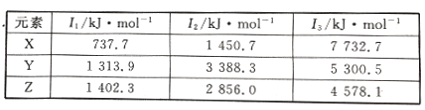
X、Y、Z中为N元素的是______,判断理由是_____________________________。
(5)N5–为平面正五边形,科学家预测将来会制出含N4–、N6–等平面环状结构离子的盐,这一类离子中都存在大π键,可用符号![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为![]() ),则N4–离子中的大π键应表示为_________。
),则N4–离子中的大π键应表示为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】东汉晚期的青铜奔马(马踏飞燕)充分体现了我国光辉灿烂的古代科技,已成为我国的旅游标志。下列说法错误的是

A.青铜是我国使用最早的合金、含铜、锡、铅等元素
B.青铜的机械性能优良,硬度和熔点均高于纯铜
C.铜器皿表面的铜绿可用明矾溶液清洗
D.“曾青(![]() )得铁则化为铜”的过程发生了置换反应
)得铁则化为铜”的过程发生了置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学合成氨法实现了氨的常温常压合成,一种碱性介质下的工作原理示意图如下所示。下列说法错误的是
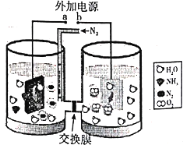
A.b接外加电源的正极
B.交换膜为阴离子交换膜
C.左池的电极反应式为![]()
D.右池中水发生还原反应生成氧气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A.氯化铝溶液中加入过量氨水:Al3++4NH3·H2O=AlO2-+4![]() +2H2O
+2H2O
B.氯气溶于水:Cl2+H2O=2H++Cl-+ClO-
C.实验室用氯化铵和熟石灰制氨:![]() +OH-
+OH-![]() NH3↑+H2O
NH3↑+H2O
D.Cu与足量的浓硝酸:Cu+2![]() +4H+=Cu2++2NO2↑+2H2O
+4H+=Cu2++2NO2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国有丰富的海水资源,开发和利用海水资源是当前科学研究的一项重要任务。下列有关海水综合利用的说法不正确的是( )
A.从海水中提炼出的氘(含HDO 0.03‰)进行核聚变,放出巨大的能量以解决能源问题,成为一条新的科学思路,HDO与H2O化学性质相同
B.从海水中提取镁可以采用下列方法:海水![]() Mg(OH)2
Mg(OH)2![]() MgCl2溶液→MgCl2·6H2O
MgCl2溶液→MgCl2·6H2O![]() MgCl2(熔融)
MgCl2(熔融)![]() Mg[
Mg[
C.从海水获得的碘,可以跟氧气反应生成多种化合物,其中一种称为碘酸碘,在该化合物中,碘元素呈+3和+5两种价态,这种化合物的化学式是I4O9
D.除去粗盐中的SO42 -、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com