
【题目】下列有关说法正确的是
A.将纯水加热后,水的电离程度增大,pH不变
B.反应2H2(g)+O2(g)=2H2O(l)在一定条件能自发进行的原因是ΔS<0
C.常温下,向0.1 mol·L-1 NH4Cl溶液中通入少量HCl,溶液中![]() 增大
增大
D.常温下,向CaCO3悬浊液中加入少量水,所得新悬浊液中c(Ca2+)减小
【答案】C
【解析】
A. 将纯水加热后,水的电离程度增大,c(H+)增大,根据定义:pH=lg(c(H+), pH变小,A选项错误;
B. ΔS<0,不利于反应自发发生,反应2H2(g)+O2(g)=2H2O(l)在一定条件能自发进行的原因是该反应放热,B选项错误;
C. 向0.1 mol·L-1NH4Cl溶液中通入少量HCl,使c(H+)增大,抑制NH4+的水解,使c(NH3 H2O)减小。根据水解常数![]() ,Kh不变,c(NH3 H2O)减小,所以溶液中
,Kh不变,c(NH3 H2O)减小,所以溶液中![]() 增大,C选项正确;
增大,C选项正确;
D. 温度不变,固体的溶解度也不变,所以,向CaCO3悬浊液中加入少量水,所得新悬浊液中CaCO3仍然饱和,浓度不变,D选项错误;
答案选C。


科目:高中化学 来源: 题型:
【题目】今有铁、水、氧化钙、碳酸钙、氢氧化钠溶液、硫酸铜溶液等六种物质,从中选出适当的物质按下述要求写出一个化学方程式。
(1)化合反应________________________
(2)分解反应________________________
(3)置换反应________________________
(4)复分解反应________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如图:
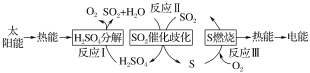
(1)反应Ⅰ:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) ΔH=+551kJ·mol-1
反应Ⅲ:S(s)+O2(g)=SO2(g) ΔH=-297kJ·mol-1
反应Ⅱ的热化学方程式:__。
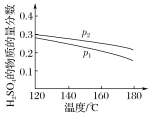
(2)对反应Ⅱ,在某一投料比时,两种压强下,H2SO4在平衡体系中物质的量分数随温度的变化关系如图所示。p2__p1(填“>”或“<”),得出该结论的理由是__。
(3)I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下。将ii补充完整。
i.SO2+4I-+4H+=S↓+2I2+2H2O
ii.I2+2H2O+__=__+__+2I-
(4)探究i、ii反应速率与SO2歧化反应速率的关系,实验如下:分别将18mLSO2饱和溶液加入到2mL下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中)
序号 | A | B | C | D |
试剂组成 | 0.4mol·L-1KI | amol·L-1KI 0.2mol·L-1H2SO4 | 0.2mol·L-1H2SO4 | 0.2mol·L-1KI 0.0002molI2 |
实验现象 | 溶液变黄,一段时间后出现浑浊 | 溶液变黄,出现浑浊较A快 | 无明显现象 | 溶液由棕褐色很快褪色,变成黄色,出现浑浊较A快 |
①B是A的对比实验,则a=__。
②比较A、B、C,可得出的结论是__。
③实验表明,SO2的歧化反应速率D>A。结合i、ii反应速率解释原因:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在焊接铜器时可用NH4Cl溶液除去铜器表面的氧化铜以便焊接,其反应为:CuO+NH4Cl → Cu+CuCl2+N2↑+H2O(未配平)。下列说法正确的是
A. 反应中被氧化和被还原的元素分别为Cu和N
B. 反应中氧化剂和还原剂的物质的量之比为3∶2
C. 反应中产生0.2 mol气体时,转移0.6 mol电子
D. 该反应中被还原的CuO占参与反应CuO的![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列不能说明氯元素的非金属性比硫元素强的是( )
①![]() 比
比![]() 稳定
稳定
②![]() 氧化性比
氧化性比![]() 强
强
③![]() 酸性比
酸性比![]() 强
强
④![]() 能与
能与![]() 反应生成S
反应生成S
⑤![]() 与
与![]() 反应生成
反应生成![]() ,S与
,S与![]() 反应生成
反应生成![]()
A.①⑤B.②C.①④D.①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丹参醇是一种中药成分,结构简式如图所示。下列关于丹参醇的描述正确的是

A.能与浓硫酸共热后发生消去反应
B.能与NaHCO3溶液反应放出气体
C.分子中含有2个手性碳原子
D.1 mol丹参醇最多能与5 mol H2发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】弱电解质在水溶液中的电离状况可以进行定量计算和推测。
(1)25℃时两种酸的电离平衡常数如表所示。
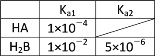
①25℃时,0.100 mol·L-1的NaA溶液中H+、OH-、Na+、A-、HA的物质的量浓度由大到小的顺序是: _______ 。pH=8的 NaA溶液中由水电离出的c(OH-)= _______ mol·L-1。
②25℃时,0.100 mol·L-1的NaHB溶液pH _______ 7,理由是 _______ 。
③25℃时,向0.100 mol·L-1的Na2B溶液中滴加足量0.100 mol·L-1的HA溶液,反应的离子方程式为_______ 。
(2)已知25℃时,向0.100 mol·L-1的H3PO4溶液中滴加NaOH溶液,各含磷微粒的物质的量分数随pH变化的关系如图所示。
①25℃,pH=3时溶液中c(H3PO4)∶c(H2PO![]() )=_______ 。
)=_______ 。
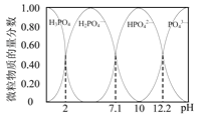
②当溶液pH由11到14时,所发生反应的离子方程式为:_______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
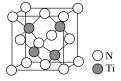
【题目】由N、P、Ti等元素组成的新型材料有着广泛的用途,请回答下列问题。
(1)钛元素基态原子未成对电子数为__个,能量最高的电子占据的能级符号为___。
(2)磷的一种同素异形体—白磷(P4)的立体构型为__,推测其在CS2中的溶解度__(填“大于”或“小于”)在水中的溶解度。
(3)两种三角锥形气态氢化物膦(PH3)和氨(NH3)的键角分别为93.6°和107°,试分析PH3的键角小于NH3的原因:__。
(4)工业上制金属钛采用金属还原四氯化钛。先将TiO2(或天然的金红石)和足量炭粉混合加热至1000~1100K,进行氯化处理,生成TiCl4。写出生成TiCl4的化学反应方程式:___。
(5)有一种氮化钛晶体的晶胞如图所示,该晶体的化学式为__,已知晶体的密度为ρg·cm-3,阿伏加德罗常数为NA,则晶胞边长为__cm(用含ρ、NA的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,溴化银在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是
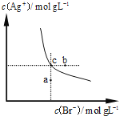
A.向溴化银悬浊液中加入溴化钠溶液,溴化银的Ksp减小
B.图中a点对应的是不饱和溶液
C.向c点对应的溶液中加入少量0.1 mol·L-1 AgNO3溶液,则c(Br-)增大
D.在AgBr饱和溶液中加入NaBr固体,可使溶液由c点变到b点
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com