
甲、乙两容器中均进行反应:N2+3H2⇌2NH3,在相同时间内,甲容器中断裂1molN≡N键且同时形成3molH﹣H键,乙容器中断裂0.5molN≡N键且同时断裂3molN﹣H键,下列说法正确的是( )
|
| A. | 甲容器中的反应速率一定大于乙容器中的反应速率 |
|
| B. | 甲容器中的反应速率可能小于乙容器中的反应速率 |
|
| C. | 无法判断两容器中的上述反应是否都达到了平衡状态 |
|
| D. | 上述两容器中的反应一定是在相同温度和相同压强下进行的 |
| 化学平衡状态的判断;化学平衡的影响因素. | |
| 分析: | 在相同时间内,甲容器中断裂1molN≡N键且同时形成3molH﹣H键,乙容器中断裂0.5molN≡N键且同时断裂3molN﹣H键,说明正逆反应速率相等,反应达到平衡状态,甲反应速率时乙反应速率的2倍,据此分析. |
| 解答: | 解:A、在相同时间内,甲容器中断裂1molN≡N键,乙容器中断裂0.5molN≡N键,说明甲容器中的反应速率一定大于乙容器中的反应速率,故A正确; B、据A中分析,甲容器中的反应速率一定大于乙容器中的反应速率,故B错误; C、在相同时间内,甲容器中断裂1molN≡N键且同时形成3molH﹣H键,乙容器中断裂0.5molN≡N键且同时断裂3molN﹣H键,说明正逆反应速率相等,反应达到平衡状态,故C错误; D、两容器中反应速率不同,温度和压强不一定相同,故D错误; 故选A. |
| 点评: | 本题考查了影响反应速率的因素和化学平衡状态的判断,题目难度不大. |


科目:高中化学 来源: 题型:
(1)中性原子的中子数:用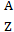 X表示原子,N= ;
X表示原子,N= ;
(2)阳离子的中子数:AXm+共有x个电子,则N= ;
(3)12C18O2分子中,中子数为 ,质子数为 ,电子数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组物质中,分别取等物质的量在足量氧气中完全燃烧,耗氧量不同的是( )
|
| A. | 乙炔和乙醛 | B. | 丁酸和乙醛 | C. | 乙二酸和氢气 | D. | 乙烷和甘油 |
查看答案和解析>>
科目:高中化学 来源: 题型:
银锌纽扣电池工作时的反应为:Zn+Ag2O+H2O=Zn(OH)2+2Ag,下列说法不正确的是( )
|
| A. | 锌是阴极,Ag2O是阳极 |
|
| B. | 电解质溶液为碱溶液,不可能是强酸溶液 |
|
| C. | 锌电极的反应式为:Zn+2OH﹣﹣2e﹣=Zn(OH)2 |
|
| D. | 若工作时转移电子0.2mol,则消耗Zn的质量为6.5g |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是( )
|
| A. | H2O的沸点比H2S的沸点高是因为O的非金属性比S的非金属性强 |
|
| B. | F2、Cl2、Br2、I2的沸点依次升高是因为它们分子间作用力依次增大 |
|
| C. | 离子化合物溶于水时离子键被破坏,共价化合物溶于水时共价键不一定改变 |
|
| D. | 只含共价键的物质不一定属于共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
按下列要求完成各小题:
(1)Na2O2的电子式 ,该化合物属于 化合物;
(2)H2O分子的结构式;
(3)NH3分子的空间构型是 ;
(4)CO2分子的球棍模型 (注意原子半径的大小);
(5)非金属性最强的元素与原子半径最小的元素形成的化合物的电子式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
国庆期间对大量盆栽鲜花施用了S-诱抗素制剂,以保证鲜花盛开。S-诱抗素的分子结
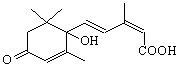 构如右图,下列关于该物质的说法正确的是
构如右图,下列关于该物质的说法正确的是
A.其分子式为C15H18O4
B.既能发生加聚反应,又能发生缩聚反应
C.分子中含有2个手性碳原子
D.既能与FeCl3溶液发生显色反应,又能使酸性KMnO4溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化学反应在金属冶炼工业中还没有得到应用的是
( )
A.2NaCl(熔融) 2Na+Cl2↑
2Na+Cl2↑
B.Al2O3+3C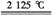 2Al+3CO↑
2Al+3CO↑
C.Fe2O3+3CO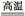 2Fe+3CO2
2Fe+3CO2
D.2Ag2O 4Ag+O2↑
4Ag+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
向含有下列离子的溶液中分别加入烧碱固体(溶液体积变化可忽略),能引起离子浓度减小的是( )
|
| A. | CO32﹣ | B. | Cl﹣ | C. | OH﹣ | D. | Cu2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com