
【题目】从古至今,铁及其化合物在人类生产生活中的作用发生了巨大改变。
(1)古代中国四大发明之一的指南针是由天然磁石制成的,其主要成分是____(填字母序号)。
a.Fe b.FeO c.Fe3O4 d.Fe2O3
(2)硫酸渣的主要化学成分为:SiO2约45%,Fe2O3约40%,Al2O3约10%,MgO约5%。用该废渣制取药用辅料红氧化铁的工艺流程如下(部分操作和条件略):
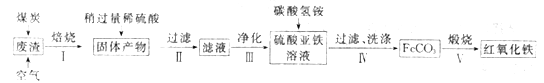
①在步骤Ⅰ中产生的有毒气体可能有_____________________。
②在步骤Ⅲ操作中,要除去的离子之一为Al3+。若常温时Ksp[Al(OH)3]=1.0×10-32,此时理论上将Al3+ 沉淀完全,则溶液的pH为_________。(c(Al3+)≤1.0×10-5mol/L 视为Al3+沉淀完全)
③步骤Ⅳ中,生成FeCO3的离子方程式是____________________________。
(3)氯化铁溶液称为化学试剂中的“多面手”。向氯化铜和氯化铁的混合溶液中加入氧化铜粉末会产生沉淀,写出该沉淀的化学式______________。请用平衡移动的原理,结合必要的离子方程式,对此现象作出解释:__________________________________________________________。
(4)①古老而神奇的蓝色染料普鲁士蓝的合成方法如下:

复分解反应Ⅱ的离子方程式是____________________________________________。
②如今基于普鲁士蓝合成原理可检测食品中是否含CN-,方案如下:
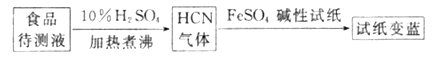
若试纸交蓝则证明食品中含有CN-,请解释检测时试纸中FeSO4的作用:____________。
【答案】c CO、SO2等 5 Fe2++2HCO3=FeCO3↓+2CO2↑+H2O Fe(OH)3 Fe3++3H2OFe(OH)3↓+3H+,加入CuO与H+反应生成Cu2+和H2O,降低了H+浓度,使得水解平衡正向移动,生成Fe(OH)3沉淀; 3[Fe(CN)6]4+4Fe3+=Fe4[Fe(CN)6]3↓ 碱性条件下,Fe2+与CN结合生成[Fe(CN)6]4,Fe2+被空气中O2氧化生成Fe3+,[Fe(CN)6]4与Fe3+反应生成普鲁士蓝使试纸显蓝色。
【解析】
根据物质的制备原理分析解答;根据物质的分离和提纯原理分析解答;根据沉淀溶解平衡原理进行溶度积的相关计算。
(1)古代中国四大发明之一的指南针是由天然磁石制成的,磁铁成分主要是四氧化三铁;
故答案为:c;
(2)①加入煤炭在空气中“还原焙烧”时产生的有毒气体可能有CO、SO2等;
故答案为:CO、SO2等;
②常温时Ksp[Al(OH)3]=1.0×1032,理论上将Al3+沉淀完全,根据Ksp=c(Al3+)·c3(OH)=1.0×1032,即c(OH)=![]() =10-9mol/L,则c(H+)=
=10-9mol/L,则c(H+)=![]() =10-5mol/L,即pH=5;
=10-5mol/L,即pH=5;
故答案为:5;
③亚铁离子和碳酸氢根离子发生双水解生成FeCO3,离子方程式为:Fe2++2HCO3=FeCO3↓+2CO2↑+H2O;
故答案为:Fe2++2HCO3=FeCO3↓+2CO2↑+H2O;
(3)因为Fe3+会水解产生较多的H+,离子方程式为:Fe3++3H2OFe(OH)3↓ +3H+,加入CuO与H+反应生成Cu2+和H2O,降低了H+浓度,使得水解平衡正向移动,生成Fe(OH)3沉淀;
故答案为:Fe(OH)3,Fe3++3H2OFe(OH)3↓+3H+,加入CuO与H+反应生成Cu2+和H2O,降低了H+浓度,使得水解平衡正向移动,生成Fe(OH)3沉淀;
(4)①由流程图可知,复分解反应ii的离子方程式为:3[Fe(CN)6]4+4Fe3+=Fe4[Fe(CN)6]3↓;
故答案为:3[Fe(CN)6]4+4Fe3+=Fe4[Fe(CN)6]3↓;
②基于普鲁士蓝合成原理可检测食品中CN,碱性条件下,Fe2+与CN结合生成[Fe(CN)6]4,Fe2+被空气中O2氧化生成Fe3+,[Fe(CN)6]4 与Fe3+反应生成普鲁士蓝使试纸显蓝色,
故答案为:碱性条件下,Fe2+与CN结合生成[Fe(CN)6]4,Fe2+被空气中O2氧化生成Fe3+,[Fe(CN)6]4与Fe3+反应生成普鲁士蓝使试纸显蓝色。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】T℃时,在2L密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的物质的量的变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Z的百分含量与时间的关系如图2所示,则下列结论正确的是
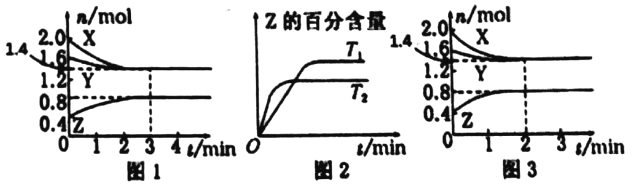
A. 容器中发生的反应可表示为3X(g)+Y(g)![]() 2Z(g)
2Z(g)
B. 反应进行的前3min内,用X表示的反应速率v(X)=0.2 mol·L-1·min-1
C. 若改变反应条件,使反应进程如图3所示,则改变的条件是增大压强
D. 保持其他条件不变,升高溫度,反应的化学平衡常数K增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CaC2、ZnC2、Al4C3、Mg2C3、Li2C2等同属于离子型碳化物,请通过CaC2制C2H2的反应进行思考,从中得到必要的启示,判断下列反应产物正确的是( )
A. Mg2C3水解生成丙炔B. Al4C3水解生成丙炔
C. ZnC2水解生成乙烷D. Li2C2水解生成乙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合肥市某高中化学非限定性课程学习小组利用铁锈(Fe2O3)做了系列实验,物质之间的关系图如下。
根据所学知识回答以下问题:

IHCl的配制
实验室用密度为1.18g/mL,质量分数为36.5%浓盐酸配制480mL0.1mol/L的盐酸溶液。
(1)配制480mL0.1mol/L的盐酸溶液需要浓盐酸的体积为___mL。(保留2位有效数字)
(2)除了烧杯、玻璃棒、量筒、胶头滴管和试剂瓶还需要的仪器有___。
(3)若出现如下情况,对所配溶液浓度将有何影响?(填“偏低”或“偏高”)
未洗涤烧杯___;定容时俯视刻线____。
II探究实验
(1)写出由A滴入到沸水中制备B的化学方程式。___
(2)下列说法正确的有___(填序号)。
①B转换成C发生了化学反应
②由A制备B,加热越久越好
③物质B具有丁达尔效应
④把B和C组成的混合物过滤,滤液是无色的
⑤整个过程都不涉及到氧化还原反应
(3)向红褐色沉淀C中加入NaClO和NaOH混合溶液,生成一种高效杀菌净水剂Na2FeO4,已知每生成0.2mol的Na2FeO4消耗0.3molNaClO,则该反应的还原产物为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱性硼化钒(VB2)-空气电池工作时反应为:4VB2+11O2 = 4B2O3+2V2O5。用该电池为电源,选用惰性电极电解硫酸铜溶液,实验装置如图所示。当外电路中通过0.04mol电子时,B装置内共收集到0.448L气体(标准状况),则下列说法正确的是( )
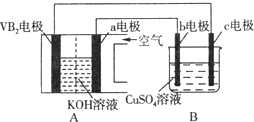
A. VB2电极发生的电极反应为:2VB2+11H2O-22e- = V2O5+2B2O3+22H+
B. 外电路中电子由c电极流向VB2电极
C. 电解过程中,c电极表面先有红色物质析出,然后有气泡产生
D. 若B装置内的液体体积为100mL,则CuSO4溶液的物质的量浓度为0.2mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是实验室制取氯气并以氯气为原料进行特定反应的装置。其中:A中盛有MnO2,B中盛有浓盐酸。

(1)用下列两种方法制取氯气:
①用含HCl146g的浓盐酸与足量的MnO2反应;
②用87gMnO2与足量的浓盐酸反应。不考虑HCl的挥发,
则两种方法生成的氯气的量是方法①___②(填“>”、“<”或“=”)。
(2)仪器B的名称是__。
(3)C中盛饱和食盐水(氯气在其中的溶解度很小),是为了除去氯气中混有的__气体。
(4)仪器D用来干燥氯气,其中盛放的试剂是__。
(5)E中装铁粉,其中发生反应的化学方程式是__。
(6)G中盛有NaOH溶液,目的是___。其中发生反应的离子方程式是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的KI和KCl固体混合物溶于水形成1000mL溶液,K+浓度为0.5mol·L-1,若向其中通入足量的Cl2,完全反应后将所得溶液蒸干,灼烧得到固体残留物比原固体混合物质量减少18.3g。
试计算:
(1)原固体混合物中KI的质量?___
(2)固体残留物中含有什么物质?___其物质的量是多少?___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】席夫碱类化合物G在催化、药物、新材料等方面有广泛应用。合成G的一种路线如下:
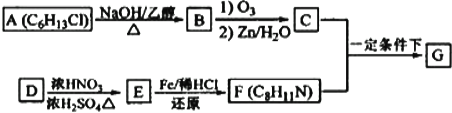
已知以下信息:
①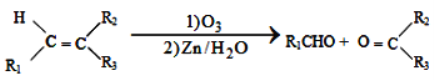
②1molB经上述反应可生成2molC,且C不能发生银镜反应。
③D属于单取代芳香烃,其相对分子质量为106。
④核磁共振氢谱显示F苯环上有两种化学环境的氢。
⑤
回答下列问题:
(1)由A生成B的化学方程式为_______________________。
(2)D的化学名称是______________________。
(3)G的结构简式为_______________________。
(4)F的同分异构体中含有苯环的还有____种(不考虑立体异构)。
(5)由苯和化合物C经如下步骤可合成N-异丙基苯胺。

反应条件2所选用的试剂是_____________________, I的结构简式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醚是有机合成中常用的溶剂。某实验小组在实验室利用乙醇脱水制备乙醚,装置示意图(夹持和加热装置已略去)、有关数据和实验步骤如下:


物质 | 相对分子质量 | 密度/(g·mL-1) | 沸点/℃ | 在水中的溶解性 |
乙醇 | 46 | 0.816 | 78 | 互溶 |
乙醚 | 74 | 0.713 | 34.6 | 不溶 |
已知:①相同条件下,乙醚在饱和食盐水中比在水中更难溶。
②氯化钙可与乙醇形成络合物CaCl2·6C2H5OH。
请回答下列问题:
(1)仪器B的名称为________。
(2)由乙醇制备乙醚的总反应为2C2H5OH![]() CH3CH2OCH2CH3+H2O,此反应分两步进行,第一步反应的化学方程式为:CH3CH2OH+H2SO4
CH3CH2OCH2CH3+H2O,此反应分两步进行,第一步反应的化学方程式为:CH3CH2OH+H2SO4![]() CH3CH2OSO2OH+H2O,则第二步反应的化学方程式为_____________。
CH3CH2OSO2OH+H2O,则第二步反应的化学方程式为_____________。
(3)仪器D中盛有冰水混合物,其作用为____________。
(4)操作1的名称为_______________。
(5)若省略步骤Ⅱ会导致的后果是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com