
【题目】某烃类化合物A用仪器可以测出其相对分子质量为84,分子中含有碳碳双键,分子中只有一种类型的氢。
(1)现有以下的实验室仪器:
A.1H核磁共振仪 B.质谱仪
C.红外光谱仪 D.元素分析仪
请你选择分别用什么仪器
①测出相对分子质量________(填字母,下同)。
②测出官能团碳碳双键________。
③测出几种类型的氢________。
(2)结合题给信息,可以判断A的结构简式为________。
(3)在如图中,D1、D2互为同分异构体,E1、E2互为同分异构体。
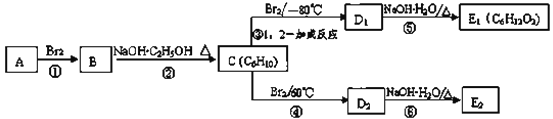
反应②的化学方程式为_________;
C的化学名称为__________;反应类型为:__________。
E2的结构简式是_________;
④、⑤的反应类型依次是________、_________。
【答案】B C A ![]()
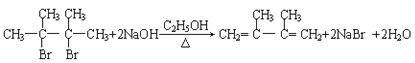 2,3-二甲基-1,3-丁二烯 消去反应 HOCH2C(CH3)=C(CH3)CH2OH 1,4-加成反应 取代反应
2,3-二甲基-1,3-丁二烯 消去反应 HOCH2C(CH3)=C(CH3)CH2OH 1,4-加成反应 取代反应
【解析】
(1)1H核磁共振仪用于测定氢原子种类;质谱仪用于测定有机物的相对分子质量;红外光谱仪用于测定有机物的中化学键的类型;元素分析仪用于测定有机物中元素的种类;
(2)A的质谱图表明其相对分子质量为84,红外光谱表明分子中含有碳碳双键,则A应为烯烃,设分子式为CnH2n,则有14n=84,n=6,根据核磁共振氢谱表明分子中只有一种类型的氢,写出结构简式;
(3)A是(CH3)2C=C(CH3)2与液溴反应生成B,B为:(CH3)2CBr-C(CH3)2Br,B在氢氧化钠、乙醇作用下加热,发生消去反应生成C,C为CH2=C(CH3)-C(CH3)=CH2,C与溴发生1,2-加成生成D1,故D1为CH2BrCBr(CH3)-C(CH3)=CH2,D1在氢氧化钠水溶液中发生水解反应生成E1,E1为HOCH2C=CCH2OH,D1、D2互为同分异构体,则反应④发生1,4-加成,D2为CH2BrC(CH3)=C(CH3)CH2Br,D2在氢氧化钠水溶液中发生水解反应生成E2,E2为HOCH2C(CH3)=C(CH3)CH2OH,据此解答。
(1)①测出相对分子质量用质谱仪,合理选项是B;②测出官能团碳碳双键用红外光谱仪,合理选项是C;③测出几种类型的氢1H用核磁共振仪,故合理选项A;
(2)A的质谱图表明其相对分子质量为84,红外光谱表明分子中含有碳碳双键,则A应为烯烃,设分子式为CnH2n,则有14n=84,n=6,又因为核磁共振氢谱表明分子中只有一种类型的氢,其结构简式应为![]() ;
;
(3)反应②是B为:(CH3)2CBr-C(CH3)2Br在氢氧化钠醇溶液、加热条件下发生消去反应,生成CH2=C(CH3)-C(CH3)=CH2,该反应的化学方程式为: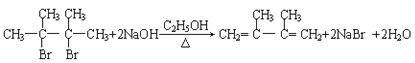 ;C为CH2=C(CH3)-C(CH3)=CH2,C的化学名称是2,3-二甲基-1,3-丁二烯,由上述分析可知,E2的结构简式是:HOCH2C(CH3)=C(CH3)CH2OH,反应④是1,4-加成反应、反应⑤是取代反应。
;C为CH2=C(CH3)-C(CH3)=CH2,C的化学名称是2,3-二甲基-1,3-丁二烯,由上述分析可知,E2的结构简式是:HOCH2C(CH3)=C(CH3)CH2OH,反应④是1,4-加成反应、反应⑤是取代反应。


科目:高中化学 来源: 题型:
【题目】臭氧(O3)在[Fe(H2O)6]2+催化下能将烟气中的SO2、NOx分别氧化为SO42-和NO3-,NOx也可在其他条件下被还原为N2。
(1)SO42-中心原子轨道的杂化类型为______;NO3-的空间构型为_____(用文字描述)。
(2)Fe2+基态核外电子排布式为_______。
(3)与O3分子互为等电子体的一种阴离子为________(填化学式)。
(4)(CN)2分子中σ键与π键的数目比n(σ)∶n(π)=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电极反应式或离子方程式与所述事实相符且正确的是( )
A. 用银作电极材料电解氯化铜溶液的阳极反应式:2Cl--2e- =Cl2↑
B. 甲烷碱性燃料电池的负极反应式:CH4 +10OH--8e- =CO32-+7H2O
C. 向FeBr2溶液中通入过量的Cl2:2Fe2++2Br-+2Cl2=2Fe3+ +Br2+4Cl-
D. 向NH4Al(SO4)2溶液中加入Ba(OH)2溶液至恰好使SO42-完全沉淀:Al3+ +2SO42-+2Ba2 ++4OH-=AlO2-+2BaSO4↓+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素在周期表中的位置如图,
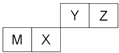
其中只有M为金属元素,下列说法不正确的是( )
A.原子半径Z<M
B.Z位于元素周期表中第二周期、第ⅥA族
C.X的最简单气态氢化物的热稳定性比Z的小
D.X的最高价氧化物不溶于任何酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无色的混合气体甲,可能含NO、CO2、NO2、N2中的几种,将一定量的甲气体经过如图实验的处理,结果得到酸性溶液,而几乎无气体剩余,则甲气体的组成为( )

A.NO2、N2B.NO、CO2
C.NO2、CO2D.NO、CO2、N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以石油化工产品为原料合成聚酯类功能高分子材料R及某药物合成原料E的一种合成路线如下(部分反应条件和产物略去):
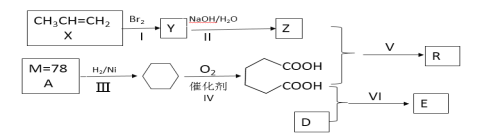
已知D与乙醇属于同系物,E在核磁共振氢谱上有3组峰且峰面积比为2∶2∶3
回答下列问题:
(1)Y的名称是____;R的官能团名称是____;E的分子式是__________。
(2)反应Ⅵ的反应类型是_____;X最多有___________个原子共面。
(3)写出II反应的化学方程式__________________。
(4)写出Y的其余几种同分异构体_________________。
(5)已知: ![]() ,参照上述合成路线,以甲苯和溴乙烷为原料合成苯甲酸乙酯,合成路线是:___________。
,参照上述合成路线,以甲苯和溴乙烷为原料合成苯甲酸乙酯,合成路线是:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)具有高效的消毒作用,为一种新型非氯高效消毒剂。以废铁屑(含有少量Ni)为主要原料制备高铁酸钾的流程如下:
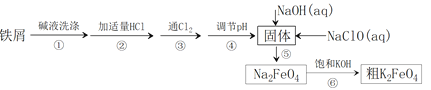
资料显示:一些金属氢氧化物开始沉淀和完全沉淀的pH如下:
M(OH)n | pH | |
开始沉淀 | 沉淀完全 | |
Fe(OH)3 | 2.53 | 2.94 |
Ni(OH)2 | 7.60 | 9.75 |
(1)高铁酸钾具有高效消毒主要是因其具有__________性所致。
(2)步骤③反应的离子方程式是_______。
(3)步骤④不能引入新杂质,调节pH所用的某种氧化物的化学式是___________,调节pH的范围是__________________。
(4)步骤⑤发生反应的离子方程式是________。
(5)该流程中可循环利用的物质是:_______(写化学式)。
(6)步骤⑥中,由Na2FeO4 得到粗K2FeO4的原理可能是___________。
(7)测定产品纯度:将wg粗产品,溶入过量的碱性亚铬酸盐溶液中,充分反应后,加入稀硫酸酸化至pH为2,在所得的重铬酸盐溶液中加入5滴二苯胺磺酸钠溶液作指示剂,然后用c mol·L1 (NH4)2Fe(SO4)2溶液滴定至终点,消耗滴定液V mL。有关滴定反应有:
Cr(OH)4-+FeO42-+3H2O![]() Fe(OH)3·3H2O↓+CrO42- +OH
Fe(OH)3·3H2O↓+CrO42- +OH
2![]() +2H
+2H![]()
![]() +H2O
+H2O
![]() +6Fe2++14H
+6Fe2++14H![]() 2Cr3++6Fe3++7H2O
2Cr3++6Fe3++7H2O
该粗产品中K2FeO4的纯度为____________(用含w、c、V的代数式表示)。若滴定管没有用待装液润洗,则测得结果________(“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】塑化剂主要用作塑料的增塑剂,也可作为农药载体、驱虫剂和化妆品等的原料。添加塑化剂(DBP)可改善白酒等饮料的口感,但超过规定的限量会对人体产生伤害。其合成线路图如图I所示: 已知以下信息:
①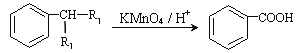
②R1CHO+R2CH2CHO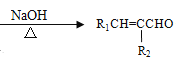 +H2O
+H2O
③C为含两个碳原子的烃的含氧衍生物,其核磁共振氢谱图如图所示
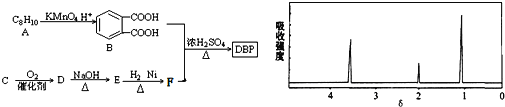
请根据以上信息回答下列问题:
(1)C的结构简式为____________, E中所含官能团的名称是____________;
(2)写出下列有关反应的化学方程式:
①E和H2以物质的量比1︰1反应生成F:______________________;
②B和F以物质的量比1︰2合成DBP:_____________________,该反应的反应类型为_____________________。
(3)同时符合下列条件的B的同分异构体有______种,写出其中任意两种同分异构体的结构简式_________________。
①不能和NaHCO3溶液反应 ②能发生银镜反应
③遇FeCl3溶液显紫色 ④核磁共振氢谱显示苯环上只有一种氢原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】液体燃料电池相比于气体燃料电池具有体积小等优点.一种以液态肼(N2H4)为燃料的电池装置如图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解质溶液.关于该电池的叙述正确的是( )

A. b极发生氧化反应
B. a极为该电池的正极
C. 放电时,电流从a极经过负载流向b极
D. a极的反应式:N2H4+4OH﹣﹣4e﹣═N2↑+4H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com