
【题目】2.0 mol PCl3和1.0 mol Cl2充入体积不变的密闭容器中,在一定条件下发生下述反应:PCl3(g)+Cl2(g)![]() PCl5(g)。达平衡时,PCl5为0.40 mol,如果此时移走1.0 mol PCl3和0.50 mol Cl2,在相同温度下再达平衡时,下列说法不正确的是
PCl5(g)。达平衡时,PCl5为0.40 mol,如果此时移走1.0 mol PCl3和0.50 mol Cl2,在相同温度下再达平衡时,下列说法不正确的是
A. PCl5的物质的量大于0.20 molB. PCl5的质量分数减少
C. 平衡常数不变D. 混合气体的黄绿色变浅
【答案】A
【解析】
A、充入2.0molPCl3和1.0molCl2反应达到平衡,产生PCl5为0.4mol,相同条件下,充入1.0molPCl3和0.50molCl2,应产生PCl3物质的量为0.20mol,但移走1.0molPCl3和0.50molCl2,相当于在原来的基础上减少1.0molPCl3和0.50molCl2,减小压强,平衡向逆反应方向移动,PCl5被消耗,其物质的量将小于0.20mol,故A说法错误;B、根据A选项分析,PCl3被消耗,其质量分数减小,故B说法正确;C、化学平衡常数只受温度的影响,温度不变,则化学平衡常数不变,故C说法正确;D、减小压强,相当增大体积,氯气的浓度降低,黄绿色变浅,故D说法正确。


 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为了探究原电池产生电流的过程,设计了如图所示实验:
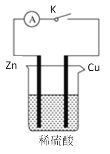
(1)下列叙述中正确的是___。
A.打开开关K时铜片作负极,关闭开关K时铜片作正极
B.打开开关K,锌片和铜片上均有气泡产生
C.关闭开关K后,溶液中的H+浓度减小
D.关闭开关K产生气泡的速率比打开开关K时慢
(2)打开开关K后,装置中发生反应的离子方程式为___。
(3)关闭开关K后,则该装置为___(填“原电池”或“电解池”),锌极为___极(填“正”、“负”、“阳”或“阴”),铜极上的电极反应式为__。若反应过程中有0.3mol的电子发生转移,则产生的气体在标准状况下的体积为___L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气是一种重要的化工原料,在工农业中都有广泛的应用。
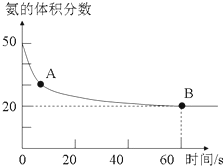
(1)NH3和CO2在120℃和催化剂的作用下可以合成尿素,反应方程式为2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g)。某实验小组向一个容积不变的真空密闭容器中充入CO2与NH3合成尿素,在恒定温度下,混合气体中NH3的体积分数随时间的变化关系如图所示(该条件下尿素为固体)。A点的正反应速率v正(CO2)___ (填“大于”“小于”或“等于”)B点的逆反应速率v逆(CO2),NH3的平衡转化率为__。
CO(NH2)2(s)+H2O(g)。某实验小组向一个容积不变的真空密闭容器中充入CO2与NH3合成尿素,在恒定温度下,混合气体中NH3的体积分数随时间的变化关系如图所示(该条件下尿素为固体)。A点的正反应速率v正(CO2)___ (填“大于”“小于”或“等于”)B点的逆反应速率v逆(CO2),NH3的平衡转化率为__。
(2)氨基甲酸铵(NH2COONH4)是合成尿素过程的中间产物,现 将体积比为2∶1的NH3和CO2混合气体充入一个容积不变的真空密闭容器中,在恒定温度下使其发生反应并达到平衡:2NH3(g)+CO2(g)![]() NH2COONH4(s)。实验测得在不同温度下的平衡数据如下表:
NH2COONH4(s)。实验测得在不同温度下的平衡数据如下表:
温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
平衡气体总浓度 (10-3mol·L-1) | 2.4 | 3.4 | 4.8 | 6.8 | 9.6 |
①上述反应的焓变:ΔH__0,熵变ΔS__0(填“>”“<”或“=”)。
②下列说法能说明上述反应建立化学平衡状态的是_______。
A.混合气体的平均相对分子质量不再发生变化
B.混合气体中NH3与CO2的浓度之比不再发生变化
C.混合气体的密度不再发生变化 D.v正(NH3)=2v逆(CO2)
③根据表中数据,列出25.0℃时该反应的化学平衡常数的计算式K=_____(不要求计算结果),该反应温度每升高10℃,化学平衡常数就变为原来的______倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为短周期元素且原子序数依次増大,质子数之和为40。B、C同周期,A、D同主族,A、C能形成两种液态化合物A2C和A2C2,E的最高价氧化物的水化物呈两性。
(1)B元素在周期表中的位置为_______。
(2)由A、C、D三种元素组成的化合物的电子式为_______。
(3)废印刷电路版上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解。現改用A2C2和稀硫酸浸泡既达到了上述目的,又保护了环境,试写出反应的化学方程式______。
(4)若BA3与C2可形成燃料电池,电解质为KOH溶液,则负极的电极反应式为______。(氧化产物不污染环境)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)为紫黑色粉末,是一种新型高效消毒剂。K2FeO4易溶于水,微溶于浓KOH溶液,在0 ℃~5 ℃的强碱性溶液中较稳定。一般制备方法是先用Cl2与KOH溶液在20 ℃以下反应生成KClO(在较高温度下则生成KClO3),KClO再与KOH、Fe(NO3)3溶液反应即可制得K2FeO4。实验装置如图所示:
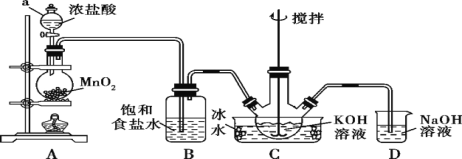
回答下列问题:
(1)制备KClO。
①仪器a的名称是________________;装置B吸收的气体是________。
②装置C中三颈烧瓶置于冰水浴中的目的是______________;装置D的作用是_____________。
(2)制备K2FeO4。
①装置C中得到足量KClO后,将三颈烧瓶上的导管取下,加入KOH溶液、Fe(NO3)3溶液,水浴控制反应温度,搅拌,当溶液变为紫红色,该反应的离子方程式为________________________________。
②向装置C中加入饱和________溶液,析出紫黑色晶体,过滤。
(3)测定K2FeO4纯度。测定K2FeO4的纯度可用滴定法,滴定时有关反应的离子方程式为:
a.FeO42-+CrO2-+2H2O═CrO42-+Fe(OH)3↓+OH-
b.2CrO42-+2H+═Cr2O72-+H2O
c.Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O
称取2.0g制备的K2FeO4样品溶于适量KOH溶液中,加入足量的KCrO2,充分反应后过滤,滤液在250mL容量瓶中定容.取25.00mL加入稀硫酸酸化,用0.10 molL-1的(NH4)2Fe(SO4)2标准溶液滴定至终点,重复操作2次,平均消耗(NH4)2Fe(SO4)2溶液的体积为24.00mL,则该K2FeO4样品的纯度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固定容积为2 L的密闭容器中发生反应xA(g)+yB(g) ![]() zC(g),图I表示200℃时容器中各物质的量随时间的变化关系,图II表示平衡时平衡常数K随温度变化的关系。结合图像判断,下列结论正确的是
zC(g),图I表示200℃时容器中各物质的量随时间的变化关系,图II表示平衡时平衡常数K随温度变化的关系。结合图像判断,下列结论正确的是
![]()
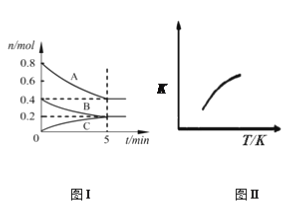
A. 200℃时,反应从开始到平衡的平均反应速率v(A)=0.08mol·L-1·min-1
B. 若0~5 min时容器与外界的热交换总量为m kJ,则该反应的热化学方程式可表示为:2A + B ![]() C ΔH = +5m kJ/mol
C ΔH = +5m kJ/mol
C. 200℃时,若在第6 min再向体系中加入1molAr,A的转化率不变
D. 200℃时,平衡后再充入2 mol B和2 mol C时,v正>v逆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列所示物质的制备方法合理的是
A.实验室从海帶中提取单质碘取样→灼烧→溶解→过滤→萃取→蒸馏
B.金红石(主要成分TiO2)为原料生产金属Ti:金红石、焦炭![]() TiCl4
TiCl4![]() Ti
Ti
C.从卤水中(溶质主要是MgCl2)提取Mg:卤水![]() Mg(OH)2
Mg(OH)2![]() MgCl2(aq)
MgCl2(aq) ![]() MgCl2(s)
MgCl2(s) ![]() Mg
Mg
D.由食盐制取漂粉精NaCl(ag) ![]() Cl2
Cl2![]() 漂粉精
漂粉精
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可通过蒸馏石油得到多种沸点范围不同的馏分,装置如图所示。下列说法不正确的是
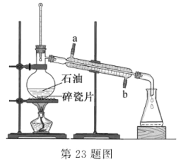
A.沸点较低的汽油比沸点较高的柴油先馏出
B.蒸馏烧瓶中放人沸石可防止蒸馏时发生暴沸
C.冷凝管中的冷凝水应该从 a 口进 b 口出
D.温度计水银球的上限和蒸馏烧瓶支管口下沿相平
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式为![]() ,下列关于该物质的说法中不正确的是
,下列关于该物质的说法中不正确的是
A. 该物质不能发生消去反应,但能在一定条件下发生加聚反应
B. 该物质不能和AgNO3溶液反应产生AgBr沉淀
C. 该物质在NaOH的醇溶液中加热可转化为醇类
D. 该物质可使溴水褪色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com