
| 沉淀物 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 5.4 | 4.0 | 1.1 | 5.8 |
| 沉淀完全pH | 6.7 | 5.2 | 3.2 | 8.8 |
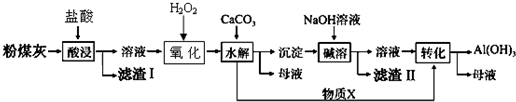
分析 粉煤灰经预处理后含Cu2O、SiO2、Al2O3、FeO化合物,用盐酸酸浸,发生反应:Cu2O+2H+=Cu+Cu2++H2O、Al2O3+6H+═2Al3++3H2O、FeO+2H+═Fe2++H2O,SiO2不反应,则滤渣I为SiO2、Cu,所得溶液中含有CuCl2、AlCl3、FeCl2及过量的HCl,加入H2O2将Fe2+氧化为Fe3+,再加入CaCO3调节pH,使Cu2+、Al3+、Fe3+转化为Cu(OH)2、Al(OH)3、Fe(OH)3沉淀,得到物质X为CO2,向过滤后得到沉淀中加入NaOH溶液,将Al(OH)3转化转化为NaAlO2,过滤得到滤渣Ⅱ中主要含有Fe (OH)3、Cu(OH)2,滤液中通入CO2得到Al(OH)3.
(1)酸性条件下,H2O2将Fe2+氧化为Fe3+,同时生成水;
(2)用酸溶解FeO,再用KMnO4溶液 或K3[Fe(CN)6]溶液检验Fe2+,注意:不能用氧化性酸,用KMnO4溶液时不能用盐酸;
(3)由上述分析可知,滤渣Ⅰ、滤渣Ⅱ的主要成分;
(4)“碱溶”时是氢氧化钠与氢氧化铝反应生成偏铝酸钠与水;
(5)加入CaCO3调节pH到3.2,过滤除去Fe(OH)3后,再加入CaCO3调节pH到5.2,过滤得到Al(OH)3.
解答 解:粉煤灰经预处理后含Cu2O、SiO2、Al2O3、FeO化合物,用盐酸酸浸,发生反应:Cu2O+2H+=Cu+Cu2++H2O、Al2O3+6H+═2Al3++3H2O、FeO+2H+═Fe2++H2O,SiO2不反应,则滤渣I为SiO2、Cu,所得溶液中含有CuCl2、AlCl3、FeCl2及过量的HCl,加入H2O2将Fe2+氧化为Fe3+,再加入CaCO3调节pH,使Cu2+、Al3+、Fe3+转化为Cu(OH)2、Al(OH)3、Fe(OH)3沉淀,得到物质X为CO2,向过滤后得到沉淀中加入NaOH溶液,将Al(OH)3转化转化为NaAlO2,过滤得到滤渣Ⅱ中主要含有Fe (OH)3、Cu(OH)2,滤液中通入CO2得到Al(OH)3.
(1)酸性条件下,H2O2将Fe2+氧化为Fe3+,同时生成水,反应离子方程式为:2 Fe 2++H2O2+2H+═2 Fe3++2H2O,
故答案为:2 Fe 2++H2O2+2H+═2 Fe3++2H2O;
(2)用酸溶解FeO,再用KMnO4溶液 或K3[Fe(CN)6]溶液检验Fe2+,注意:不能用氧化性酸,用KMnO4溶液时不能用盐酸,验证煤粉灰含有FeO必要的化学试剂为:稀硫酸、KMnO4溶液 (或稀盐酸、K3[Fe(CN)6]溶液),
故答案为:稀硫酸、KMnO4溶液 (或稀盐酸、K3[Fe(CN)6]溶液);
(3)由上述分析可知,滤渣Ⅰ的主要成分为Cu、SiO2,滤渣Ⅱ的主要成分为Fe (OH)3、Cu(OH)2,
故答案为:Cu、SiO2;Fe (OH)3、Cu(OH)2;
(4)由上述分析可知,物质X为CO2,“碱溶”时是氢氧化钠与氢氧化铝反应生成偏铝酸钠与水,反应离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,
故答案为:CO2;Al(OH)3+OH-=AlO2-+2H2O;
(5)为了获得产品Al(OH)3,从粉煤灰的盐酸浸取后的溶液开始,若只用CaCO3一种试剂,后续操作过程是:加入CaCO3调节pH到3.2,过滤除去Fe(OH)3后,再加入CaCO3调节pH到5.2,过滤得到Al(OH)3,
故答案为:加入CaCO3调节pH到3.2,过滤除去Fe(OH)3后,再加入CaCO3调节pH到5.2,过滤得到Al(OH)3.
点评 本题以工艺流程为载体,考查实验制备方案、对操作的分析评价、物质分离提纯、元素化合物知识等,综合性较强,涉及知识面较广,是对学生综合能力的考查,难度中等.


科目:高中化学 来源: 题型:选择题

| A. | 与金属钠反应时,键①断裂 | |
| B. | 与醋酸、浓硫酸共热时,键②断裂 | |
| C. | 与浓硫酸共热至170℃时,键②和④断裂 | |
| D. | 与HCl反应时,键②断裂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C3H8 C5H12 | B. | C4H6 C3H4 | C. | C2H60 C3H8O | D. | C3H6O C2H4O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 熔点/℃ | 沸点 | 化学性质 |
| S | 112.8 | 444.6 | 略 |
| S2Cl2 | -77 | 137 | 遇水生成HCl、SO2、S,300℃以上完全分解,S2Cl2+Cl$\frac{\underline{\;\;△\;\;}}{\;}$ 2SCl2 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 $?_{暗处}^{光照}$
$?_{暗处}^{光照}$ △H=+88.6kJ•mol-1
△H=+88.6kJ•mol-1查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高温下,二氧化硅与氧化钙 | B. | 常温下,硅与氢氟酸溶液 | ||
| C. | 高温下,二氧化硅与碳酸钠固体 | D. | 常温下,二氧化硅与浓硝酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com