
| 2min | 4min | 6min | 8min | �� | |
| CO | 0.07 | 0.06 | 0.06 | 0.05 | �� |
| H2 | x | 0.12 | 0.12 | 0.2 | �� |
| CH3OH | 0.03 | 0.04 | 0.04 | 0.05 | �� |
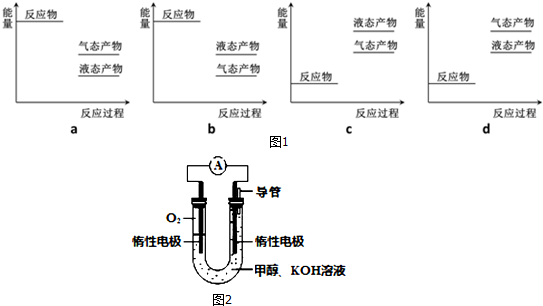
���� ��1�����ݢ��з�����֪������ӦΪ���ȷ�Ӧ����Ӧ��������������������������������̬���ʵ���������Һ̬���ʣ�������Һ̬����ų����������ࣻ
��2�����ɱ������ݿ�֪����2min��4min��CO��Ũ�ȱ仯��Ϊ��0.07-0.06��mol/L=0.01mol/L�����ݷ���ʽ����������Ũ�ȱ仯����2minʱ����Ũ��=4minʱ����Ũ��+����Ũ�ȱ仯����4min��6minʱ��COŨ����ȣ���4min��6minʱ��Ӧ����ƽ��״̬��
�ڶԱ�6min��8minʱ�����ʵ�Ũ�ȿ�֪�ı�������Ӧ��Ӧ����������У�����ת����֮�ȵ��ڼ���ϵ��֮�ȡ�C��CO������C��H2������C��CH3OH��=0.01mol/L��0.02mol/L��0.01mol/L������8min���������ʵ�Ũ��ӦΪ����0.06-0.01��mol/L����0.12-0.02��mol/L����0.04+0.01��mol/L����8min��������Ũ��Ϊ0.2mol/L�����Զ����0.1mol/L��10=1mol������������Ũ����Qc����ƽ�ⳣ������жϵ�8minʱ�Ƿ�ﵽƽ��״̬��
�����Ӽ״����ʣ�ƽ�������ƶ���
��3���ٸ�ȼ�ϵ���У�ͨ��״��ĵ缫�Ƿֽ⡢ͨ�������ĵ缫��������������ӦʽΪCH3OH-6e-+8OH-=CO32-+6H2O��
��ԭ������������������ƶ������������ƶ���
��� �⣺��1�����ݢ��з�����֪������ӦΪ���ȷ�Ӧ����Ӧ��������������������������������̬���ʵ���������Һ̬���ʣ�������Һ̬����ų����������࣬ͼ����a���ϣ�
�ʴ�Ϊ��a��
��2�����ɱ������ݿ�֪����2min��4min��CO��Ũ�ȱ仯��Ϊ��0.07-0.06��mol/L=0.01mol/L�����ݷ���ʽ��֪������Ũ�ȱ仯��Ϊ0.01mol/L��2=0.02mol/L��2minʱ����Ũ��=0.12mol/L+0.02mol/L=0.14mol/L��
�ʴ�Ϊ��0.14
�ڸ��ݢٷ�����4min��6minʱ��COŨ����ȣ���4min��6minʱ��Ӧ����ƽ��״̬����ƽ�ⳣ��K=$\frac{c��C{H}_{3}OH��}{c��CO����{c}^{2}��{H}_{2}��}$=$\frac{0.04}{0.06��0.1{2}^{2}}$=46.3���Ա�6min��8minʱ�����ʵ�Ũ�ȿ�֪�ı�������Ӧ��Ӧ����������У�����ת����֮�ȵ��ڼ���ϵ��֮�ȡ�C��CO������C��H2������C��CH3OH��=0.01mol/L��0.02mol/L��0.01mol/L������8min���������ʵ�Ũ��ӦΪ����0.06-0.01��mol/L����0.12-0.02��mol/L����0.04+0.01��mol/L����8min��������Ũ��Ϊ0.2mol/L�����Զ����0.1mol/L��10=1mol��������8minʱŨ����Qc=$\frac{0.05}{0.05��0��{2}^{2}}$=25��K=46.3����8minʱ����ƽ��״̬����Ӧ������Ӧ���У�
�ʴ�Ϊ������һ����H2�����ǣ�
��CO��g��+2H2��g��?CH3OH��g����H=-90.1kJ•mol-1���������ݻ����䣬���д�ʩ�����Ӽ״����ʣ�ƽ�������ƶ���
A�������¶ȣ��������ƶ����ʴ���
B����CH3OH��g������ϵ�з��룬ƽ�������ƶ�������ȷ��
C������He��ʹ��ϵ��ѹǿ����Ӱ��ƽ���ƶ����ʴ���
D���ٳ���1molCO��3molH2������Ӧ��Ũ�ȣ�ƽ�������ƶ�������ȷ��
��ѡBD��
��3���ٸ�ȼ�ϵ���У�ͨ��״��ĵ缫�Ƿֽ⡢ͨ�������ĵ缫��������������ӦʽΪCH3OH-6e-+8OH-=CO32-+6H2O���ʴ�Ϊ��CH3OH-6e-+8OH-=CO32-+6H2O��
��ԭ������������������ƶ������������ƶ��������������������ƶ����ʴ�Ϊ������
���� ���⿼�黯ѧƽ����㼰Ӱ�����ء�ƽ��ת���ʼ�Ӧ�á��Ȼ�ѧ����ʽ��д��ԭ���ԭ������Ӧ�ã��ۺ��Խ�ǿ���Ѷ��еȣ�


 ����ѧҵ���Ե�����ϵ�д�
����ѧҵ���Ե�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����ʽΪC5H10 ��ϩ�� | B�� | ����ʽΪC4H8O2���� | ||
| C�� | �ױ��� 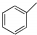 ����һ�ȴ��� ����һ�ȴ��� | D�� | ������ �� ���Ķ��ȴ��� ���Ķ��ȴ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ���� | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| Ũ��/mol•L-1 | 4��10-6 | 6��10-6 | 2��10-5 | 4��10-5 | 3��10-5 | 2��10-5 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 ��2L�ĺ����ܱ������г���A��g����B��g����������ӦA��g��+B��g��?2C��g��+D��s����H=a kJ•mol-1
��2L�ĺ����ܱ������г���A��g����B��g����������ӦA��g��+B��g��?2C��g��+D��s����H=a kJ•mol-1| ʵ����� | �¶� | ��ʼ���ʵ��� | |
| A | B | ||
| �� | 600�� | 1mol | 3mol |
| �� | 800�� | 1.5mol | 0.5mol |
| A�� | ʵ�� I�У�10 min��ƽ����Ӧ����v��B��=0.06 mol•L-1•min-1 | |
| B�� | ��������ʽ�У�a��0 | |
| C�� | 600��ʱ���÷�Ӧ��ƽ�ⳣ����0.45 | |
| D�� | ��ʵ����ƽ����ϵ���ٳ���0.5 mol A��1.5 molB��A��ת�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | ��������1 L pH=1�Ĵ�����Һ�м�ˮ��������Һ��OH-��Ŀ����0.1NA | |
| B�� | 60g�����������Ҵ�����������Ӧ����ַ�Ӧ��������ѵ�C-O����ĿΪNA | |
| C�� | ��֪C2H4��g��+H2��g��=C2H6��g����H=-137.0 kI/mol����ϩ��H2�ӳ�ʱ�ų�68.5 kJ�������� ��Ӧ�����б��ƻ���̼ԭ��֮�乲�õ��Ӷ���ĿΪNA | |
| D�� | 4.6gSO2��NO2��������к���������Ϊ2.3 NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
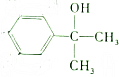 ���л�����һ���������ܺ�������ȫ�ӳɣ��ӳɲ����һ������У�������-OH��ȡ������������
���л�����һ���������ܺ�������ȫ�ӳɣ��ӳɲ����һ������У�������-OH��ȡ������������| A�� | 7�� | B�� | 6�� | C�� | 5�� | D�� | 4�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �¶����ߣ��÷�Ӧ��Ӧ���ʼӿ죬ƽ�ⳣ������ | |
| B�� | ��Ŀ������ijʱ�������淴Ӧ���ʵĴ�СΪV��������V���棩 | |
| C�� | ��10min��Ӧ�ﵽƽ�⣬���ʱ���ڷ�Ӧ����v��A��Ϊ0.064mol/��L•min�� | |
| D�� | ƽ��ʱ���ټ�������ʼ������A������ƽ���A��ת�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ù����н��������仯��û�л�ѧ�仯 | |
| B�� | �ù�����������һ�����淴Ӧ���������� | |
| C�� | �ù�����Ƶķ�Ӧ�а���HgS$\frac{\underline{\;\;��\;\;}}{\;}$Hg+S | |
| D�� | ˮ���ж������������о��Բ���ʹ�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com