
分析 (1)醋酸是弱电解质,向醋酸溶液中加入含有醋酸根离子的物质抑制醋酸电离,醋酸的电离平衡常数只与温度有关;
(2)99℃时,Kw=1.0×10-12,该温度下测得0.1mol•L-1 Na2A溶液的pH=6,说明Na2A是强酸强碱盐;
①H2A是强酸完全电离;
②酸与足量的锌反应生成氢气的量与氢离子的物质的量成正比;
(3)物质的溶度积越小,越易形成沉淀.
解答 解:(1)CH3COOH溶液中存在电离平衡CH3COOH?CH3COO-+H+,加入CH3COONa固体,c(CH3COO-)增大,平衡左移;CH3COOH的电离平衡常数K=$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$,温度不变,电离平衡常数不变,K的值不变,
故答案为:逆;不变;
(2)99℃时,Kw=1.0×10-12,该温度下纯水的pH=6,测得0.1mol•L-1 Na2A溶液的pH=6,说明Na2A是强酸强碱盐,
①H2A是强酸,在水溶液里完全电离,其电离方程式为H2A═2H++A2-,
故答案为:H2A═2H++A2-;
②酸与足量的锌反应生成氢气的量与氢离子的物质的量成正比,体积相等、pH=2的醋酸与H2A溶液醋酸提供氢离子能力强,所以与足量锌完全反应时生成的氢气,醋酸放出的多,故答案为:A;
(3)根据Al(OH)3、Fe(OH)3的溶度积常数,在25℃下,向浓度均为0.1mol•L-1的FeCl3和AlCl3的混合溶液中逐滴加入加入碳酸钙粉末,$\root{3}{4.0×1{0}^{-38}}<\root{3}{3.0×1{0}^{-34}}$,逐渐加入碳酸钙粉末,Fe(OH)3最先析出,离子反应方程式为:2Fe3++3H2O+3CaCO3=2Fe(OH)3↓+3Ca2++3CO2,故答案为:Fe(OH)3;2Fe3++3H2O+3CaCO3=2Fe(OH)3↓+3Ca2++3CO2.
点评 本题考查了弱电解质的电离平衡、盐类水解等知识点,明确弱电解质电离平衡特点及盐类水解特点是解本题关键,易错点是(2),根据盐溶液pH确定酸的强弱来分析解答,难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 反应中转移电子为0.04 mol | B. | Q中n(Cu2+):n(Fe2+)=1:2 | ||
| C. | 溶液Q比原溶液增重了 1.28 g | D. | 3c(Fe3+)+2c(Fe2+)+2c(Cu2+)=0.1 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 气体 | CO2 | HCl | HCl | SO2 |
| 液体 | H2O | NaOH | H2O | NaOH |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
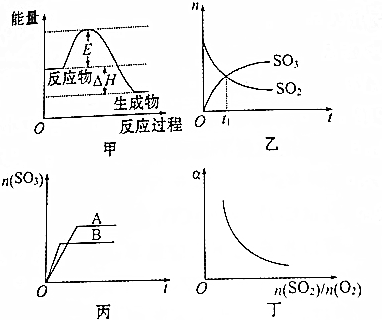
| A. | 加入适当的催化剂后,甲图中的E和△H都减小 | |
| B. | 乙图中t1时刻反应达到化学平衡状态 | |
| C. | 丙图可以表示其他条件不变时,压强对反应的影响 | |
| D. | 丁图中a可以表示SO2的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
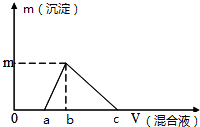 往100mL0.1mol/L NaOH溶液中逐滴滴入浓度均为0.1mol/L的氯化铝和盐酸的混合溶液,测得生成沉淀的质量(g)与滴入的混合液的体积(mL)的关系如图所示,则下列说法正确的是( )
往100mL0.1mol/L NaOH溶液中逐滴滴入浓度均为0.1mol/L的氯化铝和盐酸的混合溶液,测得生成沉淀的质量(g)与滴入的混合液的体积(mL)的关系如图所示,则下列说法正确的是( )| A. | a=25mL | B. | b=33mL | C. | c=100mL | D. | m=0.195g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.3mol | B. | 0.15mol | C. | 0.1mol | D. | 0.075mol |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
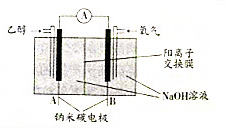
| A. | A极为电池负极,B极为电池正极 | |
| B. | B极的电极反应式为O2+2H2O+4e-═4OH- | |
| C. | 该乙醇燃料电池的总反应方程式为:C2H5OH+3O2═2CO2+3H2O | |
| D. | 当电池消耗4.6g乙醇时,经过阴离子交换膜的OH-为1.2mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com