
2 mol A与2 mol B混合于2 L的密闭容器中,发生如下反应:2A(g)+3B(g) 2C(g)+zD(g),2 s后A的转化率为50%,测得υ(D)=0.25 mol·L﹣1·s﹣1,下列推断不正确的是( )
2C(g)+zD(g),2 s后A的转化率为50%,测得υ(D)=0.25 mol·L﹣1·s﹣1,下列推断不正确的是( )
A. z=2 B. 2 s后,容器内的压强是初始的7/8倍
C. 2 s后,B的浓度为0.5 mol/L D. 2 s时C的体积分数为2/7
科目:高中化学 来源:2017届福建省高三下学期模考4理科综合化学试卷(解析版) 题型:选择题
下列说法不正确的是
A.液晶态介于晶体状态和液态之间,液晶具有一定程度的晶体的有序性和液体的流动性
B.常压下,0℃时冰的密度比水的密度小,水在4℃时密度最大,这些都与分子间的氢键有关
C.石油裂解、煤的干馏、玉米制醇、蛋白质的变性和纳米银粒子的聚集都是化学变化
D.燃料的脱硫脱氮、SO2的回收利用和NOx的催化转化都是减少酸雨产生的措施
查看答案和解析>>
科目:高中化学 来源:北京市怀柔区2016-2017学年度第一学期期末考试高二化学试卷 题型:选择题
下列实验中,所采取的分离方法与对应原理都正确的是
选项 | 目 的 | 分离方法 | 原 理 |
A | 分离溶于水中的碘 | 乙醇萃取 | 碘在乙醇中的溶解度较大 |
B | 分离乙酸乙酯和乙醇 | 分液 | 乙酸乙酯和乙醇的密度不同 |
C | 除去KNO3固体中混杂的NaCl | 重结晶 | NaCl在水中的溶解度很大 |
D | 除去丁醇中的乙醇 | 蒸馏 | 丁醇与乙醇的沸点相差较大 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源:湖北省沙市2016-2017学年高二下学期第三次双周考化学试卷(A卷) 题型:填空题
X、Y、M、Z、R为前四周期元素,且原子序数依次增大。XY2是红棕色气体;X与氢元素可形成XH3;M是周期表中电负性最大的元素;Z基态原子的M层是K层电子数的3倍;R2+离子的3d轨道中有9个电子。请回答下列问题:
(1)基态Y原子的价电子排布图是______;Z所在周期中第一电离能最大的主族元素是_______(元素名称)
(2)XY2? 离子的立体构型是________;R2+的水合离子[R(H2O)4]2+中,提供孤电子对的原子是________(元素符号)。
(3)已知XH3易与R2+形成配离子,但XM3不易与R2+形成配离子,其原因是_______________。
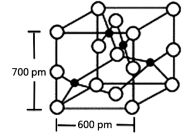
(4)Y与R所形成的化合物晶体晶胞如图所示,该晶体的化学式:_____________;晶胞参数如图所示,则该晶胞密度是___________g?cm-3(列式并计算结果,保留小数点儿后一位)。
(5)图1表示某种含氮有机化合物的结构,其分子内4个氮原子分别位于正四面体的4个顶点(见图2),分子内存在空腔,能嵌入某离子或分子并形成4个氢键予以识别。下列分子或离子中,能被该有机化合物识别的是________(填标号)。
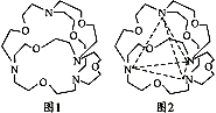
a.CF4 b.CH4 c.NH4+ d.H2O
查看答案和解析>>
科目:高中化学 来源:湖北省沙市2016-2017学年高二下学期第三次双周考化学试卷(A卷) 题型:选择题
增强铝的耐腐蚀性,现以铅蓄电池以外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使表面表面的氧化膜增厚。反应原理如下:电池:Pb(s)+PbO2(s)+2H2SO4(aq)═2PbSO4(s)+2H2O (I)
电解池:2Al+3H2O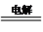 Al2O3+3H2↑
Al2O3+3H2↑
电解过程中,以下判断正确的是
电池 | 电解池 | |
A | H+移向Pb电极 | H+移向Pb电极 |
B | 每消耗3mol Pb | 生成2mol Al2O3 |
C | 正极:PbO2+4H++2e-═Pb2++2H2O | 阳极:2Al+3H2O-6e-═Al2O3+6H+ |
D |
|
|
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源:湖北省沙市2016-2017学年高二下学期第三次双周考化学试卷(A卷) 题型:选择题
高氯酸、硫酸、硝酸和盐酸都是强酸,其酸性在水溶液中差别不大。四种物质在冰醋酸中的电离
常数如表。从表格中判断以下说法中不正确的是( )
HClO4 | H2SO4 | HCl | HNO3 | |
Ka | 1.6×10﹣5 | 6.3×10﹣9 | 1.6×10﹣9 | 4.2×10﹣10 |
A. 在冰醋酸中高氯酸是这四种酸中最强的酸
B. 在冰醋酸中这四种酸都没有完全电离
C. 在冰醋酸中硫酸的电离方程式为H2SO4=2H++SO42﹣
D. 酸的强弱与其本身的结构和溶剂的性质有关
查看答案和解析>>
科目:高中化学 来源:湖北省沙市2016-2017学年高二下学期第三次双周考化学试卷(A卷) 题型:选择题
下列各组物质汽化或熔化时,所克服的微粒间的作用力属同种类型的是( )
A. 二氧化硅和生石灰的熔化 B. 碘和干冰的升华 C. 氯化钠和铁的熔化 D. 食盐和冰的熔化
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省达州市年高二上学期期末检测化学试卷(解析版) 题型:实验题
(Ⅰ)某化学兴趣小组要完成中和热的测定.回答下列问题:
(1)实验桌上备有大、小两个烧杯、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌棒、0.5mol•L﹣1盐酸、0.55mol•L﹣1NaOH溶液,实验尚缺少的玻璃用品是_______.
(2)已知:反应后溶液的比热容c为4.18J·℃﹣1•g﹣1,0.5mol•L﹣1盐酸和0.55mol·L﹣1NaOH溶液的密度均为1g·cm﹣3.实验时记录的实验数据如下:
实验 次数 | 反应物及用量 | 溶 液 温 度 | ||
t1 | t2 | |||
1 | 50mL0.55mol•L-1NaOH溶液 | 50mL.0.5mol•L-1HCl溶液 | 20℃ | 23.3℃ |
2 | 50mL0.55mol•L-1NaOH溶液 | 50mL.0.5mol•L-1HCl溶液 | 20℃ | 23.5℃ |
①盐酸和氢氧化钠反应的中和热△H1=____________(保留两位小数)
②已知:CH3COOH(aq) CH3COO-(aq)+H+(aq) △H2>0 ,
CH3COO-(aq)+H+(aq) △H2>0 ,
CH3COOH(aq)+OH-(aq)= CH3COO-(aq)+H20(l) △H3 则△H3_____△H1(填“>”、“<”、“=”)
(Ⅱ)某实验小组利用硫酸酸化的KMnO4与H2C2O4反应来探究“外界条件对化学反应速率的影响”。该小组实验方案如下(实验测定KMnO4溶液完全褪色时间)。回答下列问题:
实验 编号 | H2C2O4溶液 | 酸性KMnO4溶液 | H2O/mL | 温度/℃ | KMnO4溶液完全褪色时间(s) | ||
浓度/mol·L-1 | 体积/mL | 浓度/mol·L-1 | 体积/mL | ||||
① | 0.20 | 2.0 | 0.010 | 4.0 | 2.0 | 25 | t1 |
② | 0.20 | 4.0 | 0.010 | 4.0 | 0 | 25 | t2 |
③ | 0.20 | 4.0 | 0.010 | 4.0 | 0 | 50 | t3 |
(3)上述反应的离子方程式为______________________________________
(4)t1_____ t2(填“>”、“<”、“=”),其理由是__________________
(5)实验②和实验③两组实验的目的是______________________________
(6)有同学做实验时发现,硫酸酸化的KMnO4与H2C2O4反应开始时,溶液褪色慢,但反应一段时间后溶液褪色明显加快。针对上述实验现象,该同学提出下列猜想:
猜想①:硫酸酸化的KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快。
猜想②:__________________(请你补充)
要证实猜想②,除硫酸酸化的高锰酸钾溶液、草酸溶液外,还需要选择的试剂是______。
A.硫酸钾 B.硫酸锰 C.水 D.氯化锰
查看答案和解析>>
科目:高中化学 来源:2017届浙江省教育绿色评价联盟高三3月适应性考试(选考)化学试卷(解析版) 题型:选择题
下列离子方程式书写正确的是( )
A. NaHCO3溶液与过量的澄清石灰水反应:Ca2++OH-+HCO3-=CaCO3↓+H2O
B. 用食醋除去热水瓶水垢中CaCO3:CaCO3+2H+=Ca2++CO2↑+H2O
C. 向氢氧化钡溶液中滴加足量稀硫酸:Ba2++OH-+SO42 -+H+=BaSO4↓+H2O
D. 金属钠和水反应:Na+2H2O=Na++2OH-+H2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com