
| A. | SO2通入高锰酸钾酸性溶液中,红色褪去 | |
| B. | SO2通入品红溶液中,红色褪去 | |
| C. | SO2通入溴水溶液中,红棕色褪去 | |
| D. | SO2通入氢氧化钠与酚酞的混合溶液中,红色褪去 |
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 将某有机物通入酸性高锰酸钾溶液中,溶液褪色,则该有机物一定是不饱和烃 | |
| B. | 向甲苯和乙醇中分别加入少量水,振荡后分层的是甲苯 | |
| C. | 向乙苯和苯中分别滴加溴水,溶液褪色的是乙苯 | |
| D. | 向溴乙烷和己烷中滴加硝酸银溶液,产生浅黄色沉淀的是溴乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | R有多种氧化物 | B. | R的气态氢化物很稳定 | ||
| C. | R的非金属性比Cl的非金属性强 | D. | R的最高价氧化物的水化物是强碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
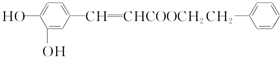
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
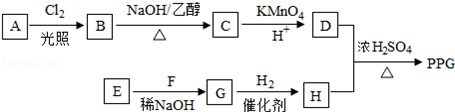
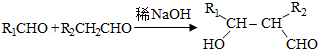
 .
.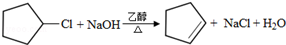 .
.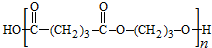 .
.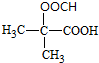 (写结构简式).
(写结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 氟 | 氯 | 溴 | 碘 | 铍 | |
| 第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 | 900 |
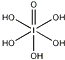 )和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6<HIO4(填“>”、“<”或“=”)
)和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6<HIO4(填“>”、“<”或“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | X 能形成化学式为X(OH)3的物质 | |
| B. | X 可能形成化学式为KXO3的物质 | |
| C. | X 原子的最外层电子数一定比核电荷数少10 | |
| D. | X 可能形成化学式为KX 的物质物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com