
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:
| 化学方程式 | 平衡常数K |
| F2+H22HF | 6.5×1095 |
| Cl2+H22HCl | 2.6×1033 |
| Br2+H22HBr | 1.9×1019 |
| I2+H22HI | 8.7×102 |
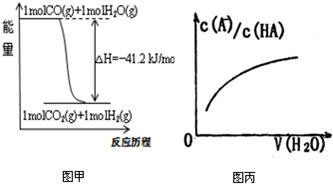
| A、已知CO的燃烧热283kJ/mol,2H2(g)+O2(g)=2H2O(g);△H=-483.6kJ/mol,则图甲表示CO和H2O(g)生成CO2和H2的能量变化 | ||
| B、某温度下,pH=11的NH3?H2O和pH=1的盐酸等体积混合后(不考虑混合后溶液体积的变化)恰好完全反应,反应后的溶液中NH4+、NH3?H2O与NH3三种微粒的平衡浓度之和为0.05mol?Lˉ1 | ||
| C、在常温下,X2(g)和H2反应生成HX的平衡常数如表乙所示,仅依据K的变化,就可以说明在相同条件下,平衡时X2(从F2到I2)的转化率逐渐降低,且X2与H2反应的剧烈程度逐渐减弱 | ||
D、图丙中曲线表示常温下向弱酸HA的稀溶液中加水稀释过程中,
|
查看答案和解析>>
科目:高中化学 来源: 题型:
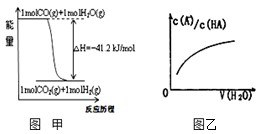 关于下列各图的叙述错误的是( )
关于下列各图的叙述错误的是( )| 化学方程式 | 平衡常数K |
| F2+H2?2HF | 6.5×1095 |
| Cl2+H2?2HCl | 2.6×1033 |
| Br2+H2?2HBr | 1.9×1019 |
| I2+H2?2HI | 8.7×102 |
| A、已知1molCO燃烧放出的热为283kJ,2H2(g)+O2(g)=2H2O(g);△H=-483.6kJ/mol则图甲表示CO和H2O(g)生成CO2和H2的能量变化 | ||
| B、常温下0.4 mol?L-1 HB溶液和0.2 mol?L-1NaOH溶液等体积混合后溶液的pH=3,则混合溶液中离子浓度的大小顺序为:c(B-)>c(Na+)>c(H+)>c(OH-) | ||
| C、常温下,X2(g)和H2反应生成HX的平衡常数如表所示,仅依据K的变化,就可以说明在相同条件下,平衡时X2(从F2到I2)的转化率逐减小,且HX的还原性逐渐减弱 | ||
D、图乙中曲线表示常温下向弱酸HA的稀溶液中加水稀释过程中,
|
查看答案和解析>>
科目:高中化学 来源: 题型:
关于下列各图的叙述错误的是 ( )
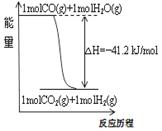 |

| 化学方程式 | 平衡常数K |
| F2+H2 | 6.5×1095 |
| Cl2+H2 | 2.6×1033 |
| Br2+H2 | 1.9×1019 |
| I2 + H2 | 8.7×102 |
图 甲 表 乙 图 丙
A.已知1molCO燃烧放出的热为283kJ,2H2(g)+O2(g)=2H2O(g);ΔH= - 483.6kJ/mol则图甲表示CO和H2O(g)生成CO2和H2的能量变化
B.常温下0.4 mol·L-1 HB溶液和0.2 mol·L-1NaOH溶液等体积混合后溶液的pH=3,则混合溶液中离子浓度的大小顺序为:c(B-)> c(Na+)>c(H+)>c(OH-)
C.常温下,X2(g)和H2反应生成HX的平衡常数如表乙所示,仅依据K的变化,就可以说明在相同条件下,平衡时X2(从F2到I2)的转化率逐减小,且HX的还原性逐渐减弱
D.图丙中曲线表示常温下向弱酸HA的稀溶液中加水稀释过程中,![]() 的变化情况
的变化情况
查看答案和解析>>
科目:高中化学 来源: 题型:
关于下列各图的叙述错误的是 ( )

图甲 表乙 图丙
A.已知1molCO燃烧放出的热为283kJ,2H2(g)+O2(g)=2H2O(g);ΔH= - 483.6kJ/mol则图甲表示CO和H2O(g)生成CO2和H2的能量变化
B.常温下0.4 mol·L-1 HB溶液和0.2 mol·L-1NaOH溶液等体积混合后溶液的pH=3,则混合溶液中离子浓度的大小顺序为:c(B-)> c(Na+)>c(H+)>c(OH-)
C.常温下,X2(g)和H2反应生成HX的平衡常数如表乙所示,仅依据K的变化,就可以说明在相同条件下,平衡时X2(从F2到I2)的转化率逐渐减小,且HX的还原性逐渐减弱
D.图丙中曲线表示常温下向弱酸HA的稀溶液中加水稀释过程中,![]() 的变化情况
的变化情况
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com