
| A. | 加入少量NaNO3溶液 | B. | 加入少量CuSO4溶液 | ||
| C. | 加入少量CH3COONa固体 | D. | 改用98%的浓硫酸 |
分析 锌与稀硫酸反应,为了减缓反应速率但又不影响生成氢气的总量,可减小氢离子浓度但不改变其物质的量,注意稀硝酸、浓硫酸与锌反应生成的不是氢气,以此解答该题.
解答 解:A.加入硝酸钠溶液后,硝酸根离子在酸性条件下具有强氧化性,与锌反应生成NO,影响了氢气的量,故A错误;
B.加入硫酸铜溶液,锌与铜离子反应生成铜,锌与铜形成原电池,加快了反应速率,故B错误;
C.加入CH3COONa固体,硫酸变为醋酸,氢离子的浓度减小但不能改变氢离子的物质的量,则减慢反应速率,又不影响生成氢气的总量,故C正确;
D.改用98%的浓硫酸,锌与浓硫酸反应生成的是二氧化硫,不会生成氢气,故D错误;
故选C.
点评 本题考查了影响化学反应速率的因素,题目难度不大,明确题干暗含条件的含义为解答关键,注意掌握化学反应速率及其影响因素,试题培养了学生的灵活应用能力.


 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:推断题
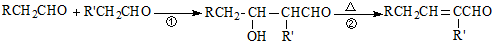

 ,B
,B .
. +
+ $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$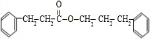 +H2O.
+H2O.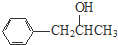 、
、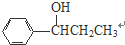 、
、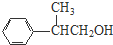 、
、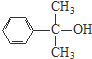 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
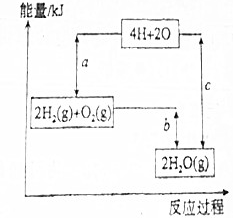
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 、
、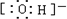 、
、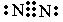 、
、 、
、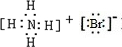 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
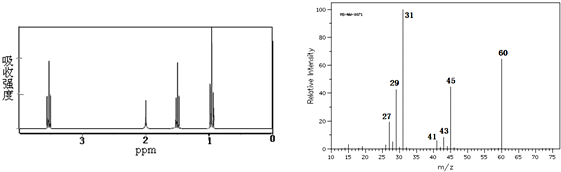
| A. | CH3CH2CH2OH | B. | CH3CH(OH)CH3 | C. | CH3CH2OCH3 | D. | CH3CH2CH2CHO |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
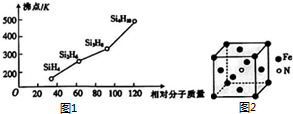 太阳能电池板材料中除含有单晶体硅外,还含有铜、铁、硒等物质.
太阳能电池板材料中除含有单晶体硅外,还含有铜、铁、硒等物质.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com